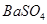题目内容
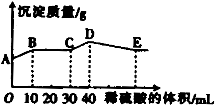
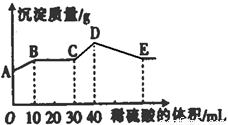
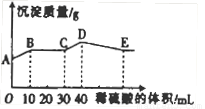
将由NaOH、BaCl2、Al2(SO4)3三种固体组成的混合物溶于足量的水中,充分溶解,向混合物液中滴加1mol?L-1的稀硫酸,加入稀硫酸的体积与生成沉淀的质量关系如图所示.下列有关判断不正确的是( )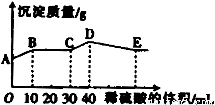
A.AB段发生反应的离子方程式为:Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O
B.BC段发生反应的离子方程式为:H++OH-=H2O
C.D点表示的沉淀的化学式为Al(OH)3、BaSO4
D.E点表示的溶液呈中性
【答案】分析:由A点可知,A点白色硫酸钡沉淀,则BaCl2过量,由NaOH、BaCl2、Al2(SO4)3三种固体组成的混合物溶于足量的水中,充分溶解,混合液中含有钡离子、氢氧根离子、偏铝酸根离子、硫酸根离子,则AB段发生生成硫酸钡沉淀和水的反应,BC段发生酸碱中和,CD段发生偏铝酸根离子与酸的反应,DE段发生氢氧化铝与酸的反应,以此来解答.
解答:解:由A点可知,A点白色硫酸钡沉淀,则BaCl2过量,由NaOH、BaCl2、Al2(SO4)3三种固体组成的混合物溶于足量的水中,充分溶解,混合液中含有钡离子、氢氧根离子、偏铝酸根离子、硫酸根离子,
A.由图象可知,AB段发生生成硫酸钡沉淀和水的反应,离子反应为Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O,故A正确;
B.BC段发生酸碱中和,离子方程式为H++OH-=H2O,故B正确;
C.CD段发生偏铝酸根离子与酸的反应,离子反应为AlO2-+H++H2O=Al(OH)3↓,故C正确;
D.DE段发生氢氧化铝与酸的反应生成硫酸铝,为强酸弱碱盐,水解使溶液显酸性,故D错误;
故选D.
点评:本题考查离子反应方程式的书写及图象,难度较大,明确A点的意义及混合液中的离子、离子反应的先后顺序是解答本题的关键.
解答:解:由A点可知,A点白色硫酸钡沉淀,则BaCl2过量,由NaOH、BaCl2、Al2(SO4)3三种固体组成的混合物溶于足量的水中,充分溶解,混合液中含有钡离子、氢氧根离子、偏铝酸根离子、硫酸根离子,
A.由图象可知,AB段发生生成硫酸钡沉淀和水的反应,离子反应为Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O,故A正确;
B.BC段发生酸碱中和,离子方程式为H++OH-=H2O,故B正确;
C.CD段发生偏铝酸根离子与酸的反应,离子反应为AlO2-+H++H2O=Al(OH)3↓,故C正确;
D.DE段发生氢氧化铝与酸的反应生成硫酸铝,为强酸弱碱盐,水解使溶液显酸性,故D错误;
故选D.
点评:本题考查离子反应方程式的书写及图象,难度较大,明确A点的意义及混合液中的离子、离子反应的先后顺序是解答本题的关键.

练习册系列答案
相关题目

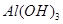 、
、