题目内容
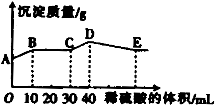
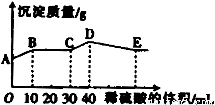
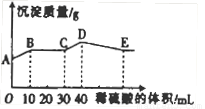
将由NaOH、BaCl2、Al2(SO))3三种固体组成的混合物溶于足量的水中,充分溶解,向混合溶液中滴加1mol·L-1的稀硫酸,加入稀硫酸的体积与生成沉淀的质量关系如图所示。下列有关判断不正确的是( )
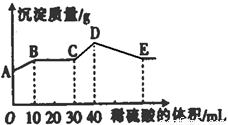
A.AB段发生反应的离子方程式为:Ba2++SO42-=BaSO4↓
B.E点对应横坐标稀硫酸的体积为70 ml
C.D点表示的沉淀的化学式为Al(OH)3、BaSO4
D.E点沉淀比A点沉淀质量大2.33g
A
【解析】
试题分析:将由NaOH、BaCl2、Al2(SO))3完全溶解可能发生的反应有:Ba2++SO42-=BaSO4↓;4OH-+Al3+=AlO2-+2H2O. 向混合溶液中滴加1mol/L的稀硫酸,可能发生的反应有:A—B: Ba2++2OH-+2H++SO42-= BaSO4↓+2H2O ;B—C:H++OH-=H2O ;C—D:AlO2-+H+ +H2O=Al(OH)3↓;D—E:3H++Al(OH)3=Al3++ 3H2O.故选项A错误。根据从C---D与D—E的方程式可看出:使AlO2-转化为氢氧化铝沉淀消耗的H+与使氢氧化铝沉淀溶解消耗的H+的物质的量知比为:1:3,使AlO2-转化为氢氧化铝沉淀消耗的硫酸体积为10ml,所以溶解沉淀消耗硫酸体积为30ml..故到E 点一共消耗硫酸的体积是40ml+30ml=70ml.故选项B正确。根据上述反应过程中方程式的分析可得出D点表示的沉淀的化学式为Al(OH)3、BaSO4。选项C正确。A点是部分SO42-反应产生的沉淀值,E点是所有SO42-反应产生的沉淀值。根据A—B:Ba2++2OH-+2H++SO42-= BaSO4↓+2H2O的关系可知:n(BaSO4)= n(H2SO4)= 0.01L×1mol/L=0.01mol.故E点沉淀比A点沉淀质量大2.33g。正确。
考点:考查向由NaOH、BaCl2、Al2(SO))3三种固体组成的混合物溶于足量的水中与硫酸反应的情况。

 阅读快车系列答案
阅读快车系列答案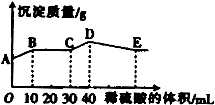

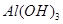 、
、