题目内容
13.X、Y、Z、J、Q五种短周期主族元素,原子序数依次增大,元素Z在地壳中含量最高,J元素的焰色反应呈黄色,Q的最外层电子数与其电子总数比为3:8,X能与J形成离子化合物,且J+的半径大于X-的半径,Y的氧化物是形成酸雨的主要物质之一.请回答:(1)Q元素在周期表中的位置第三周期ⅥA族;
(2)这五种元素原子半径从大到小的顺序为Na>S>N>O>H(填元素符号)
(3)元素的非金属性Z>Q(填“>”或“<”),下列各项中,不能说明这一结论的事实有c(填序号)
A.Q的氢化物的水溶液放置在空气中会变浑浊
B.Z与Q之间形成的化合物中元素的化合价
C.Z和Q的单质的状态
D.Z和Q在周期表中的位置
(4)Q的氢化物与Z的某种氢化物反应的化学方程式为H2S+H2O2=S↓+2H2O
(5)X与Y可形成分子A,也可形成阳离子B,A、B在水溶液中酸、碱性恰好相反,写出A的电子式
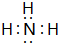 ;B的水溶液不呈中性的原因NH4++H2O?NH3.H2O+H+(用离子方程式表示)
;B的水溶液不呈中性的原因NH4++H2O?NH3.H2O+H+(用离子方程式表示)(6)液态A类似X2Z,也能微弱电离且产生电子数相同的两种离子,则液态A的电离方程式为2NH3?NH4++NH2-;
(7)若使A按下列途径完全转化为F:
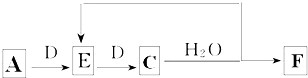
①F的化学式为HNO3;
②参加反应的A与完全转化为F时整个过程中消耗D的物质的量之比为1:2.
分析 X、Y、Z、J、Q五种短周期主族元素,原子序数依次增大,元素Z在地壳中含量最高,则Z为O元素;J元素的焰色反应呈黄色,则J为Na;Q的最外层电子数与其电子总数比为3:8,原子序数大于Na元素,故Z处于第三周期,则Q为S元素;X能与J形成离子化合物,且J+的半径大于X-的半径,可推知X为H元素;Y的氧化物是形成酸雨的主要物质之一,结合(5)中X与Y可形成分子,也可形成阳离子,则Y为N元素.
(1)主族元素周期数=电子层数、主族族序数=最外层电子数;
(2)同周期自左而右原子半径减小,电子层越多原子半径越大;
(3)同主族自上而下非金属性减弱,可利用气态氢化物的稳定性、单质之间的置换反应来、元素相互化合时化合价等说明,物质状态属于物理性质,不能比较非金属性强弱;
(4)硫化氢与过氧化氢反应生成S与水;
(5)X与Y可形成分子A,也可形成阳离子B,A、B在水溶液中酸、碱性恰好相反,A为NH3,B为NH4+,溶液中铵根离子水解,溶液呈酸性;
(6)液态NH3类似H2O,也能微弱电离且产生电子数相同的两种离子,则产生的两种离子为NH4+、NH2-;
(7)A为NH3,与D连续反应生成C,C与水反应得到E,则D为O2,E为NO、C为NO2、F为HNO3.
解答 解:X、Y、Z、J、Q五种短周期主族元素,原子序数依次增大,元素Z在地壳中含量最高,则Z为O元素;J元素的焰色反应呈黄色,则J为Na;Q的最外层电子数与其电子总数比为3:8,原子序数大于Na元素,故Z处于第三周期,则Q为S元素;X能与J形成离子化合物,且J+的半径大于X-的半径,可推知X为H元素;Y的氧化物是形成酸雨的主要物质之一,结合(5)中X与Y可形成分子,也可形成阳离子,则Y为N元素.
(1)Q为S元素,原子核外有3个电子层、最外层电子数为6,处于周期表中第三周期ⅥA族,
故答案为:第三周期ⅥA族;
(2)同周期自左而右原子半径减小,电子层越多原子半径越大,故原子半径:Na>S>N>O>H,
故答案为:Na>S>N>O>H;
(3)O、S同主族自上而下非金属性减弱,故非金属性O>S;
a.H2S的水溶液放置在空气中会变浑浊,说明氧气能氧化硫化氢生成硫,则氧气的氧化性大于S,说明O元素非金属较强,故正确;
b.S与O元素形成的化合物中S元素表现正化合价,O元素表现负化合价,氧原子对键合电子吸引力更大,故氧元素非极性较强,故正确;
c.单质状态属于物理性质,不能比较非金属性强弱,故错误;
d.同主族自上而下非金属性减弱,故非金属性O>S,故正确,
故答案为:>;c;
(4)硫化氢与过氧化氢反应生成S与水,反应方程式为:H2S+H2O2=S↓+2H2O,
故答案为:H2S+H2O2=S↓+2H2O;
(5)X与Y可形成分子A,也可形成阳离子B,A、B在水溶液中酸、碱性恰好相反,A为NH3,电子式为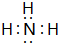 ,B为NH4+,溶液中铵根离子水解:NH4++H2O?NH3.H2O+H+,溶液呈酸性,
,B为NH4+,溶液中铵根离子水解:NH4++H2O?NH3.H2O+H+,溶液呈酸性,
故答案为: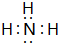 ;NH4++H2O?NH3.H2O+H+;
;NH4++H2O?NH3.H2O+H+;
(6)液态NH3类似H2O,也能微弱电离且产生电子数相同的两种离子,则产生的两种离子为NH4+、NH2-,电离方程式为:2NH3?NH4++NH2-,故答案为:2NH3?NH4++NH2-;
(7)A为NH3,与D连续反应生成C,C与水反应得到E,则D为O2,E为NO、C为NO2、F为HNO3.
①F的化学式为HNO3,故答案为:HNO3;
②设氨气为1mol,完全转化为硝酸,根据电子转移守恒,需要氧气$\frac{1mol×[5-(-3)]}{4}$=2mol,故整个过程中氨气与消耗氧气物质的量之比为1:2,故答案为:1:2.
点评 本题考查结构性质位置关系应用、元素化合物推断,注意根据(5)中信息确定Y,(7)中注意利用整个过程中电子转移守恒计算,避免过程法的繁琐,难度中等.

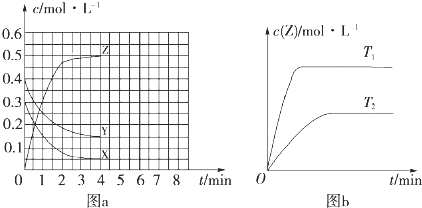
| A. | 发生反应时,各物质的反应速率大小关系为v(X)=v (Y)=2 v (Z) | |
| B. | 图a 中反应达到平衡时,Y 的转化率为37.5% | |
| C. | T0 时,该反应的平衡常数为 33.3 | |
| D. | 该反应正反应的反应热△H<0 |
| A. | 将纯水加热到90℃ | B. | 向水中加少量Na2CO3溶液 | ||
| C. | 向水中加少量NaOH溶液 | D. | 向水中加少量FeCl3溶液 |
| A. | 元素A、B组成的化合物常温下一定呈气态 | |
| B. | 元素C、D的最高价氧化物对应的水化物之间不能发生反应 | |
| C. | 工业上常用电解法制备元素C、D、E的单质 | |
| D. | 化合物AE与CE有相同类型的化学键 |
| A. | W和X均位于第二周期 | B. | Y和Z分别是Al和Si | ||
| C. | W和X分别是O和F | D. | Z的金属性可能比X强 |
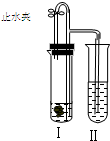 如图所示装置进行实验(图中铁架台等仪器均已略去).在Ⅰ中加入试剂后,塞紧橡皮塞,立即打开止水夹,Ⅱ中有气泡冒出;一段时间后关闭止水夹,Ⅱ中液面上升,溶液由无色变为浑浊.不符合以上实验现象的Ⅰ和Ⅱ中应加入的试剂是( )
如图所示装置进行实验(图中铁架台等仪器均已略去).在Ⅰ中加入试剂后,塞紧橡皮塞,立即打开止水夹,Ⅱ中有气泡冒出;一段时间后关闭止水夹,Ⅱ中液面上升,溶液由无色变为浑浊.不符合以上实验现象的Ⅰ和Ⅱ中应加入的试剂是( )| A | B | C | D | |
| Ⅰ | CaCO3、稀HCl | Fe、稀H2SO4 | NaHCO3、稀H2SO4 | Al、稀NaOH |
| Ⅱ | AgNO3 | NaOH | MgCl2 | AlCl3 |
| A. | A | B. | B | C. | C | D. | D |
| A. | N5+中氮-氮之间是以共价键结合 | B. | N5+具有35个电子 | ||
| C. | 化合物N5AsF6中As的化合价为+5 | D. | 化合物N5AsF6中F的化合价为-1 |
| A. | 连二苯 | B. | 连三苯  | C. | 菲 | D. | 蒽  |