题目内容
已知2SO2(g)+O2(g)![]() 2SO3(g);△H<0的实验数据如下表:
2SO3(g);△H<0的实验数据如下表:
| 温度 | 不同压强下SO2的转化率(%) | ||||
| 1×105Pa | 5×105Pa | 1×106Pa | 5×106Pa | 1×107Pa | |
| 450℃ | 97.5 | 98.9 | 99.2 | 99.6 | 99.7 |
| 550℃ | 85.6 | 92.9 | 94.9 | 97.7 | 98.3 |
⑴应选的温度是 。
⑵应采用的压强是 ,理由是 。
⑶在合成的SO3过程中,不需要分离出SO3的原因是 。
:⑴450℃;⑵1×105Pa 因为常压下SO2的转化率已经很高,若采用较大的压强,SO2的转化率提高很少,但需要动力更大,对设备的要求更高;⑶因为SO2的转化率比较高,达到平衡后的混合气体中SO2的余量很少,故不需要分离SO3。
解析:
工业生产中既要考虑反应速率快,又要考虑原料转化率高,同时也要考虑实现条件的限制。当它们出现矛盾时,两者都要兼顾,特别要适应催化剂的活性。该反应与合成氨相似,但实际情况又不完全相同,故解题时应理论联系实际,依据合成SO3的实验数据来解答。该反应与合成氨的反应相似:都是气体体积缩小的放热反应,温度升高有利于加快反应速率,但降低了反应物的转化率,适宜的条件的选择需要综合考虑。增大压强有利于加快反应速率,同时也提高了反应物的转化率,但压强对SO2的转化率影响不大,同时加压需要动力因素、设备耐压因素,综合经济效益,生产过程中采用在常压下进行最合理。由于SO2的转化率比较高,达到平衡后的混合气体中SO2的余量很少,故不需要分离SO3。

练习册系列答案
相关题目
已知2SO2(g)+O2(g)═2SO3(g),△H=-197.8kJ?mol-1,则反应:SO3 (g)═
O2 (g)+SO2 (g)的△H是( )
| 1 |
| 2 |
| A、+197.8kJ?mol-1 |
| B、+98.9kJ?mol-1 |
| C、-296.7kJ?mol-1 |
| D、-98.9kJ?mol-1 |
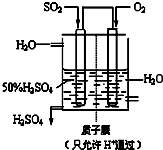
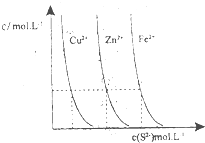 以下是对化学反应变化过程及结果的研究.按要求回答问题:
以下是对化学反应变化过程及结果的研究.按要求回答问题: