题目内容
(15分)【化学—选修3:物质结构与性质】
a、b、c、d、f五种前四周期元素,原子序数依次增大;a、b、c三种元素的基态原子具有相同的能层和能级,第一电离能I1(a)<I1(c)<I1(b),且其中基态b原子的2p轨道处于半充满状态; d为周期表前四周期中电负性最小的元素;f的原子序数为29。请回答下列问题。(如需表示具体元素请用相应的元素符号)
(1)写出ac2的电子式__________;基态f原子的外围电子排布式为 。
(2)写出一种与ac2互为等电子体的物质的化学式 。
(3)b的简单氢化物的沸点比同族元素氢化物的沸点 。(填“高”或“低”)
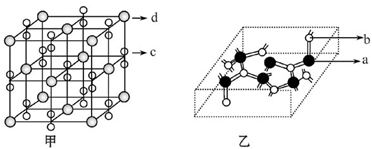
(4)化合物M由c、d两种元素组成,其晶胞结构如甲,则M的化学式为 。
(5)化合物N的部分结构如乙,N由a、b两元素组成,则硬度超过金刚石。试回答:①N的晶体类型为________________________,其硬度超过金刚石的原因是___________________。
②N晶体中a、b两元素原子的杂化方式均为___________________。
a、b、c、d、f五种前四周期元素,原子序数依次增大;a、b、c三种元素的基态原子具有相同的能层和能级,第一电离能I1(a)<I1(c)<I1(b),且其中基态b原子的2p轨道处于半充满状态; d为周期表前四周期中电负性最小的元素;f的原子序数为29。请回答下列问题。(如需表示具体元素请用相应的元素符号)
(1)写出ac2的电子式__________;基态f原子的外围电子排布式为 。
(2)写出一种与ac2互为等电子体的物质的化学式 。
(3)b的简单氢化物的沸点比同族元素氢化物的沸点 。(填“高”或“低”)

(4)化合物M由c、d两种元素组成,其晶胞结构如甲,则M的化学式为 。
(5)化合物N的部分结构如乙,N由a、b两元素组成,则硬度超过金刚石。试回答:①N的晶体类型为________________________,其硬度超过金刚石的原因是___________________。
②N晶体中a、b两元素原子的杂化方式均为___________________。
(除标注外,每空2分,共15分)
(1)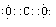 3d104s1
3d104s1
(2) N2O(写NO2+也计分)
(3) 高
(4) KO2
(5) ① 原子晶体 (1分)
C—N键的键长小于C—C键,C—N键的键能大于C—C键 (合理答案均计分) ②SP3
(1)
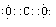 3d104s1
3d104s1 (2) N2O(写NO2+也计分)
(3) 高
(4) KO2
(5) ① 原子晶体 (1分)
C—N键的键长小于C—C键,C—N键的键能大于C—C键 (合理答案均计分) ②SP3
试题分析:a、b、c三种元素的基态原子具有相同的能层和能级,说明三种元素属于同周期元素,基态b原子的2p轨道处于半充满状态;所以b是N元素,第一电离能I1(a)<I1(c)<I1(b),则a、c分别是C、O元素;d为周期表前四周期中电负性最小的元素,则d是K元素;f的原子序数为29,f是Cu元素。
(1)二氧化碳的电子式为
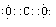 ;基态f原子的外围电子的排布式为3d104s1 ;
;基态f原子的外围电子的排布式为3d104s1 ;(2)CO2是3原子16价电子的分子,与之互为等电子体的物质有N2O;
(3)N的氢化物是NH3,氨气分子间能形成氢键使沸点升高,所以b的简单氢化物的沸点比同族元素氢化物的沸点高;
(4)根据“均摊法”,甲中d的个数为8×1/8+6×1/6=4,c2的个数是12×1/4+1=4,所以M的化学式为KO2
(5)①N的硬度超过金刚石,所以N是原子晶体;N原子的半径比C小,所以C-N的键长比C-C的键长短键能大,共价键强,硬度大。
②N晶体中,C原子周围都是4个共价单键,所以是sp3杂化,N原子周围是3个根据单键,还有1对未成键电子,所以也是sp3杂化。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目