题目内容
化学在环境保护中起着十分重要的作用.催化反硝化法和电化学降解法可用于治理水中硝酸盐的污染.
(1)催化反硝化法中,H2能将NO3-还原为N2.25℃时,反应进行l0min,溶液的pH由7变为12.
①N2的结构式为______.
②上述反应的离子方程式为______,其平均反应速率v(NO3-)为______mol?L-1?min-1.
③还原过程中可生成中间产物NO2-,写出2种促进NO2-水解的方法
______.
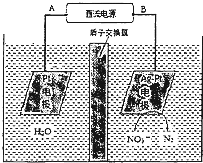
(2)电化学降解NO3-的原理如图所示.
①电源正极为______(填“A”或“B”),阴极反应式为:______.
②若电解过程中转移了2mol电子,则膜两侧电解液的质量变化差______(△m左-△m右)为g.
(1)催化反硝化法中,H2能将NO3-还原为N2.25℃时,反应进行l0min,溶液的pH由7变为12.
①N2的结构式为______.
②上述反应的离子方程式为______,其平均反应速率v(NO3-)为______mol?L-1?min-1.
③还原过程中可生成中间产物NO2-,写出2种促进NO2-水解的方法
______.
(2)电化学降解NO3-的原理如图所示.
①电源正极为______(填“A”或“B”),阴极反应式为:______.
②若电解过程中转移了2mol电子,则膜两侧电解液的质量变化差______(△m左-△m右)为g.

(1)①N2分子中氮原子间通过氮氮三键结合,因此其结构式为N≡N,故答案为:N≡N;
②利用溶液pH变化可知有OH-生成,再结合原子守恒可写出反应的离子方程式为:
2NO3-+5H2=N2+2OH-+4H2O,利用离子方程式知v(NO3-)=v(OH-)=
mol/(L?min)=0.001 mol/(L?min),
故答案为:2NO3-+5H2=N2+2OH-+4H2O,0.001;
③亚硝酸盐水解是吸热反应,且水解时生成氢氧根离子,稀释亚硝酸盐溶液能促进其水解,所以要使NO2-水解使溶液中c(OH-)变大,可促进NO2-水解的措施有加热、加水或加酸等,故答案为:加水、升高温度、加酸;
(2)①由图示知在Ag-Pt电极上NO3-发生还原反应,因此Ag-Pt电极为阴极,则B为负极,A为电源正极;在阴极反应是NO3-得电子发生还原反应生成N2,利用电荷守恒与原子守恒知有H2O参与反应且有水生成,
所以阴极上发生的电极反应式为:2NO3-+12H++10e-=N2+6H2O,
故答案为:A,2NO3-+12H++10e-=N2+6H2O;
②转移2mol电子时,阳极(阳极反应为H2O失电子氧化为O2和H+)消耗1mol水,产生2molH+进入阴极室,阳极室质量减少18g;阴极室中放出0.2molN2(5.6g),同时有2molH+(2g)进入阴极室,因此阴极室质量减少3.6g,故膜两侧电解液的质量变化差(△m左-△m右)=18g-3.6g=14.4g,
故答案为:14.4.
②利用溶液pH变化可知有OH-生成,再结合原子守恒可写出反应的离子方程式为:
2NO3-+5H2=N2+2OH-+4H2O,利用离子方程式知v(NO3-)=v(OH-)=
| 10-2-10-7 |
| 10 |
故答案为:2NO3-+5H2=N2+2OH-+4H2O,0.001;
③亚硝酸盐水解是吸热反应,且水解时生成氢氧根离子,稀释亚硝酸盐溶液能促进其水解,所以要使NO2-水解使溶液中c(OH-)变大,可促进NO2-水解的措施有加热、加水或加酸等,故答案为:加水、升高温度、加酸;
(2)①由图示知在Ag-Pt电极上NO3-发生还原反应,因此Ag-Pt电极为阴极,则B为负极,A为电源正极;在阴极反应是NO3-得电子发生还原反应生成N2,利用电荷守恒与原子守恒知有H2O参与反应且有水生成,
所以阴极上发生的电极反应式为:2NO3-+12H++10e-=N2+6H2O,
故答案为:A,2NO3-+12H++10e-=N2+6H2O;
②转移2mol电子时,阳极(阳极反应为H2O失电子氧化为O2和H+)消耗1mol水,产生2molH+进入阴极室,阳极室质量减少18g;阴极室中放出0.2molN2(5.6g),同时有2molH+(2g)进入阴极室,因此阴极室质量减少3.6g,故膜两侧电解液的质量变化差(△m左-△m右)=18g-3.6g=14.4g,
故答案为:14.4.

练习册系列答案
相关题目
 2NO(g),在密闭容器中,下列条件的改变引起该反应的反应速率的变化是什么(填在横线上)。
2NO(g),在密闭容器中,下列条件的改变引起该反应的反应速率的变化是什么(填在横线上)。 4C(气)+5D(气)
4C(气)+5D(气)