题目内容
19.某同学用下列装置制备并检验Cl2的性质.
(1)Ⅰ图圆底烧瓶中反应的化学方程式为MnO2+4HCl(浓)$\frac{\underline{\;△\;}}{\;}$MnCl2+Cl2↑+2H2O.
(2)Ⅱ图中褪色的是b (填“a”或“b”),Ⅱ图烧杯中发生反应的化学方程式是Cl2+2NaOH═NaCl+NaClO+H2O.
(3)将铜丝换成铁丝,做Ⅲ实验,结果也能点燃,你认为铁丝也能点燃的理由是D(填选项字母).
A.Fe与Cu都是金属元素 B.Fe的熔点比Cu高 C.Fe的密度比Cu小 D.Fe的金属性比Cu强
(4)实验室也可用氯酸钾与盐酸反应制备氯气.当使用K37ClO3与H35Cl制备时,所得氯气的平均相对分子质量是70.7(保留一位小数)
(5)ClO2是一种广谱型的消毒剂,根据世界环保联盟的要求ClO2将逐渐取代Cl2成为生
产自来水的消毒剂.工业上ClO2常用NaClO3和Na2SO3溶液混合并加H2SO4酸化后反应制得,请写出该方法制备ClO2的化学反应方程式2NaClO3+Na2SO3+H2SO4═2ClO2↑+2NaSO4+H2O.
分析 (1)二氧化锰与浓盐酸反应生成氯气;
(2)干燥的氯气没有漂白性,次氯酸具有漂白性;氯气与NaOH反应生成NaCl和NaClO、水;
(3)Fe的金属性比Cu强,能与氯气反应生成氯化铁;
(4)K37ClO3+6H35Cl=K35Cl+35Cl37Cl↑+35Cl2↑+3H2O,据此分析;
(5)在酸性条件下,NaClO3和Na2SO3溶液混合反应生成ClO2.
解答 解:(1)二氧化锰与浓盐酸反应生成氯气,其反应的方程式为:MnO2+4HCl(浓)$\frac{\underline{\;△\;}}{\;}$MnCl2+Cl2↑+2H2O;
故答案为:MnO2+4HCl(浓)$\frac{\underline{\;△\;}}{\;}$MnCl2+Cl2↑+2H2O;
(2)干燥的氯气没有漂白性,氯气与水发应生成次氯酸,次氯酸具有漂白性,所以b褪色;氯气与NaOH反应生成NaCl和NaClO、水,其反应的方程式为:Cl2+2NaOH═NaCl+NaClO+H2O;
故答案为:b;Cl2+2NaOH═NaCl+NaClO+H2O;
(3)将铜丝换成铁丝,做Ⅲ实验,结果也能点燃,因为Fe的金属性比Cu强,能与氯气反应生成氯化铁;
故答案为:D;
(4)K37ClO3+6H35Cl=K35Cl+35Cl37Cl↑+235Cl2↑+3H2O,反应产物中有一个35Cl37Cl和两个35Cl2,则氯气的平均相对分子质量是$\frac{35+37+35×4}{3}$=70.7;
故答案为:70.7;
(5)在酸性条件下,NaClO3和Na2SO3溶液混合反应生成ClO2,其反应方程式为:2NaClO3+Na2SO3+H2SO4═2ClO2↑+2NaSO4+H2O;
故答案为:2NaClO3+Na2SO3+H2SO4═2ClO2↑+2NaSO4+H2O.
点评 本题考查了气体的实验室制法、反应原理、物质的性质,题目难度中等,侧重于考查学生的实验能力和对基础知识的综合应用能力.

| A. | 电力 | B. | 核能 | C. | 太阳能 | D. | 氢能 |
| A. | 化学键既存在于相邻原子间又存在于相邻分子间 | |
| B. | 两个原子间的相互作用叫化学键 | |
| C. | 化学键通常指的是相邻的两个或多个原子之间的强烈的相互作用 | |
| D. | 化学键的实质是静电吸引 |
| A. | 稀硫酸滴在铜片上:Cu+2H+=Cu2++H2↑ | |
| B. | 氢氧化钡与稀硫酸混合:SO42-+H++OH-+Ba2+=H2O+BaSO4↓ | |
| C. | 用稀硫酸洗去铁锈:Fe2O3+6H+=2 Fe3++3H2O | |
| D. | 石灰乳与Na2CO3溶液混合:Ca2++CO32-=CaCO3↓ |
| 压强/MPa G体积分数/% 温度/℃ | 1.0 | 2.0 | 3.0 |
| 810 | 54.0 | a | b |
| 915 | c | 75.0 | d |
| 1000 | e | f | 83.0 |
上述①~④中正确的有( )
| A. | 4个 | B. | 3个 | C. | 2个 | D. | 1个 |
| A. | 92.3% | B. | 87.6% | C. | 75% | D. | 84.9% |

 ;
; ;
; 和
和
 和
和
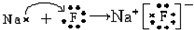 .
.