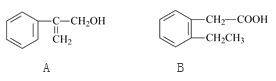
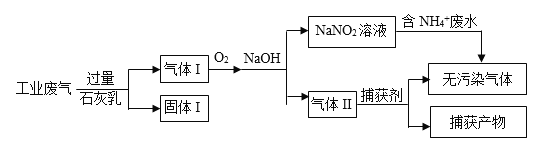
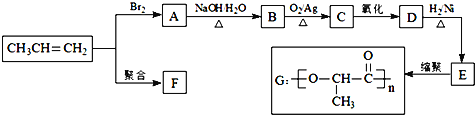
题目内容
【题目】下列除去杂质的方法正确的是
物质 | 杂质 | 试剂 | 主要操作 | |
A | NaHCO3 | Na2CO3 | ---- | 灼烧 |
B | SiO2 | Fe2O3 | 盐酸 | 过滤 |
C | KBr溶液 | Br2 | KOH溶液 | 分液 |
D | Cl2 | HCl | 饱和碳酸钠溶液 | 洗气 |
A.AB.BC.CD.D
【答案】B
【解析】
A.Na2CO3受热不分解,不能用加热法除去NaHCO3中的少量Na2CO3,故A错误;
B.SiO2与盐酸不反应,Fe2O3与盐酸反应生成溶液,然后过滤即可除去杂质,故B正确;
C.Br2与KOH溶液反应生成溶液,与KBr溶液不分层,不能分液除去,故C错误;
D.Cl2与HCl均能和饱和碳酸钠溶液反应,应选饱和食盐水,故D错误;
故答案为B。

【题目】下表1是常温下几种弱酸的电离常数(K),表2是常温下几种难(微)溶物的溶度积常数(Ksp)。
表1几种弱酸的电离常数(25℃)
酸 | 电离常数(K) |
CH3COOH | 1.8×10-5 |
HNO2 | 5.1×10-4 |
HCN | 6.2×10-10 |
HClO | 3×10-8 |
表2几种难溶电解质的溶度积(25℃)
难(微)溶物 | 溶度积常数(Ksp) |
BaSO4 | 1.1×10-10 |
MgCO3 | 6.8×10-6 |
CaSO4 | 9.1×10-6 |
CaCO3 | 2.8×10-9 |
请回答下列问题:
(1)表1四种酸中,酸性最强的是____________(用化学式表示)。会使醋酸溶液中CH3COOH的电离程度增大,而电离常数不变的操作是__________。
A.升高温度 B.加水稀释
C.加少量的CH3COONa固体 D.加少量冰醋酸
(2)常温下,相同物质的量浓度的表1中4种酸的钠盐pH由大到小的顺序是______________________________ (填钠盐的化学式)。若将pH=3的CH3COOH溶液与pH=11的NaOH溶液等体积混合,溶液中各离子浓度由大到小的排列顺序是______________________________。
(3)①根据表2四种难(微)溶物的溶度积常数计算BaSO4的溶解度_______________(单位用g/L)表示,(已知![]() )。
)。
②在含有100mL0.2mol/L Ba2+、Ca2+、Mg2+的混合溶液中加入100mL0.1mol/LNa2SO/span>4溶液,反应后溶液中生成的沉淀是_________,此时SO42-的浓度是_________。