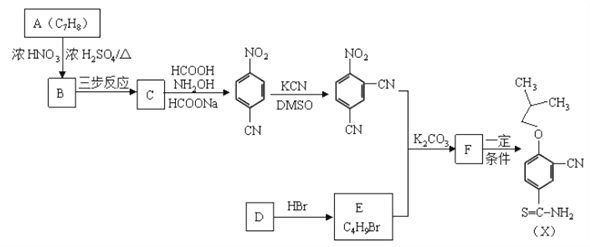
题目内容
【题目】氮及其化合物存在如下转化关系:
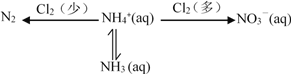
(1)在氨氮废水中通入一定量的氯气,利用产生的HClO可除去废水中含有的游离氨或铵盐。
已知 NH4+ + HClO ![]() NH2Cl + H+ + H2O H = a kJmol-1
NH2Cl + H+ + H2O H = a kJmol-1
2NH2Cl + HClO ![]() N2 + H2O + 3H+ + 3Cl- H = b kJmol-1
N2 + H2O + 3H+ + 3Cl- H = b kJmol-1
则 2NH4+ + 3HClO ![]() N2 + 3H2O + 5H+ + 3Cl- H =______kJmol-1
N2 + 3H2O + 5H+ + 3Cl- H =______kJmol-1
(2)电解法也可除去水中的氨氮,实验室用石墨电极电解一定浓度的(NH4)2SO4与NaCl的酸性混合溶液来模拟。
① 电解时,阳极的电极反应式为________。
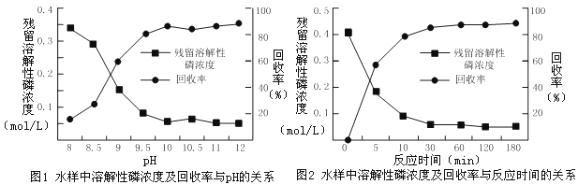
② 电解过程中,溶液初始Cl-浓度和pH对氨氮去除速率与能耗(处理一定量氨氮消耗的电能)的影响关系如图1和图2所示。

图1 Cl-浓度对氨氮去除速率、能耗的影响 图2初始pH对氨氮去除速率、能耗的影响
图1中当Cl-浓度较低时、图2中当初始pH达到12时,均出现氨氮去除速率低而能耗高的现象,共同原因是________;图2中,pH为6时处理效果最佳,当pH过低时,处理效果不佳的原因可能是________。
③ 当溶液中Cl-浓度较高时,测得溶液中的NO![]() 浓度会随之增大,可能的原因是________。
浓度会随之增大,可能的原因是________。
(3)某工厂将含NH4+废水的去除与工业废气(主要含N2、CO2、SO2、NO、CO,不考虑其他成分)的去除结合起来,设计了如下方案:
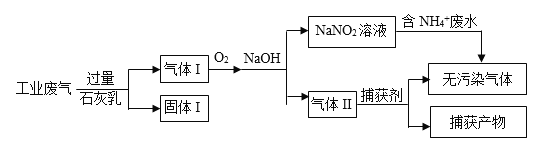
① 固体I的成分为________。
② 为使100L 150 mg/L(浓度均以氮原子计,下同)的含NH4+ 废水达到国家二级排放标准10mg/L,图中通入的氧气在标准状况下的体积至少为________L。
【答案】 2a + b 2Cl--2e- ![]() Cl2↑ (或Cl--2e-+ H2O
Cl2↑ (或Cl--2e-+ H2O ![]() HClO + H+或2NH-6e-
HClO + H+或2NH-6e-![]() N2+ 8H+或3H2O + NH-8e-
N2+ 8H+或3H2O + NH-8e- ![]() NO
NO![]() + 10H+) 阳极可能OH-放电,产生大量氧气,消耗电能 c(H+)增加,Cl2与水反应平衡(Cl2+ H2O
+ 10H+) 阳极可能OH-放电,产生大量氧气,消耗电能 c(H+)增加,Cl2与水反应平衡(Cl2+ H2O ![]() Cl-+ H+ + HClO)逆向移动,产生的Cl2从溶液中逸出 Cl-浓度较高时,产生的Cl2(或HClO)较多,会将NH氧化为NO
Cl-+ H+ + HClO)逆向移动,产生的Cl2从溶液中逸出 Cl-浓度较高时,产生的Cl2(或HClO)较多,会将NH氧化为NO![]() Ca(OH)2、CaCO3、CaSO3 33.6
Ca(OH)2、CaCO3、CaSO3 33.6
【解析】(1)已知① NH4+ + HClO = NH2Cl + H+ + H2O H = a kJmol-1②2NH2Cl + HClO = N2 + H2O + 3H+ + 3Cl- H = b kJmol-1,2×①+②得,则 2NH4+ + 3HClO = N2 + 3H2O + 5H+ + 3Cl- H =( 2a + b) kJmol-1;(2)① 电解时,阳极失去电子发生氧化反应,阳极的电极反应式为 2Cl--2e- = Cl2↑ (或Cl--2e-+ H2O = HClO + H+或2NH-6e-= N2+ 8H+或3H2O + NH-8e- = NO![]() + 10H+)。②图1中当Cl-浓度较低时、图2中当初始pH达到12时,均出现氨氮去除速率低而能耗高的现象,共同原因是氨氮去除速率低而能耗高的原因可能是阳极发生的反应为4OH--4e-=O2↑+H2O,则阳极可能OH-放电,产生大量氧气,消耗电能;当Cl-浓度较高时,测得溶液中的NO3-浓度也较高,可能的原因是Cl-浓度较高时,产生的Cl2(或HClO)较多,会将NH氧化为NO
+ 10H+)。②图1中当Cl-浓度较低时、图2中当初始pH达到12时,均出现氨氮去除速率低而能耗高的现象,共同原因是氨氮去除速率低而能耗高的原因可能是阳极发生的反应为4OH--4e-=O2↑+H2O,则阳极可能OH-放电,产生大量氧气,消耗电能;当Cl-浓度较高时,测得溶液中的NO3-浓度也较高,可能的原因是Cl-浓度较高时,产生的Cl2(或HClO)较多,会将NH氧化为NO![]() 。(3)① 固体I中有过量的Ca(OH)2、以及吸收CO2、SO2后生成的CaCO3、CaSO3,固体I的成分为Ca(OH)2、CaCO3、CaSO3 。
。(3)① 固体I中有过量的Ca(OH)2、以及吸收CO2、SO2后生成的CaCO3、CaSO3,固体I的成分为Ca(OH)2、CaCO3、CaSO3 。
② 氮的物质的量为:100L(150 mg·L-1-10mg·L-1 )=14000mg=14g,n(N)=14g/14g·mol-1=1mol,图中-3的氮升高到+3价,由电子守恒:n(N)×(3-(-3))=n(O2)×4,n(O2)= ![]() =1.5mol,V(O2)=1.5mol×22.4L/mol=33.6L。
=1.5mol,V(O2)=1.5mol×22.4L/mol=33.6L。

【题目】下列除去杂质的方法正确的是
物质 | 杂质 | 试剂 | 主要操作 | |
A | NaHCO3 | Na2CO3 | ---- | 灼烧 |
B | SiO2 | Fe2O3 | 盐酸 | 过滤 |
C | KBr溶液 | Br2 | KOH溶液 | 分液 |
D | Cl2 | HCl | 饱和碳酸钠溶液 | 洗气 |
A.AB.BC.CD.D
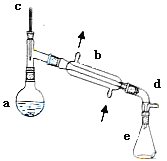
【题目】醇脱水是合成烯烃的常用方法,实验室合成环己烯的反应和实验装置如下:
![]()
可能用到的有关数据如下:
相对分子质量 | 密度/(g·cm-3) | 沸点/℃ | 溶解性 | |
环己醇 | 100 | 0.9618 | 161 | 微溶于水 |
环己烯 | 82 | 0.8102 | 83 | 难溶于水 |
合成反应:在a中加入20g环己醇和2小片碎瓷片,冷却搅动下慢慢加入1mL浓硫酸,b中通入冷却水后,开始缓慢加热a,控制馏出物的温度不超过90℃。
分离提纯:反应粗产物倒入分液漏斗中,分别用少量5%碳酸钠溶液和水洗涤,分离后加入无水氯化钙颗粒,静置一段时间后弃去氯化钙,最终通过蒸馏得到纯净环己烯10g。
回答下列问题:
(1)装置b的名称____________。
(2)如果加热一段时间后发现忘记加瓷片,应该采取的正确操作是________。(填正确答案标号)
A.立刻补加 B.冷却后补加 C.不需补加 D.重新配料
(3)本实验中最容易产生的副产物的结构简式为____________。
(4)在本实验的分离过程中,产物应从分液漏斗的____________。(填“上口倒出”或“下口倒出”)
(5)分离提纯过程中加入无水氯化钙的目的是____________。
(6)在环己烯粗产物蒸馏过程中,不可能用到的仪器有________。(填正确答案标号)
A.圆底烧瓶 B.温度计 C.吸滤器 D.球形冷凝管 E.接收器
(7)本实验所得到的环己烯产率是________。(填正确答案标号)
A.41% B.50% C.61% D.70%