题目内容
【题目】甲醛(HCHO)在化工、医药、农药等的方面有广泛应用。
(1)甲醇脱氢法可制备甲醛(反应体系中各物质均为气态),结合如图图像回答问题。
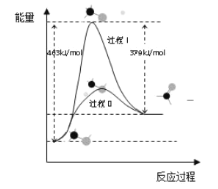
①此反应的热化学方程式是______。
②反应活化能:过程I______过程II (填“>”“=”或“<”)
③过程II温度—转化率图如图,下列说法合理的是_____。
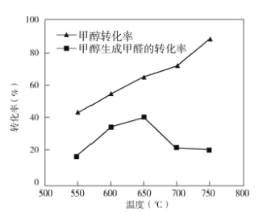
A.甲醇脱氢法制备甲醛过程无副反应发生
B.温度高于650°C催化剂烧结,活性减弱
C.及时分离产品有利于提高甲醇生成甲醛的转化率
(2)甲醛超标会危害人体健康,需对甲醛往行含量检测及污染处理。
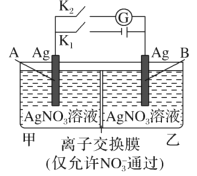
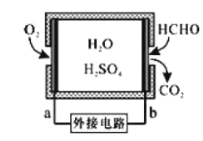
①某甲醛气体传感器的工作原理如图所示,b极的电极反应式为_________
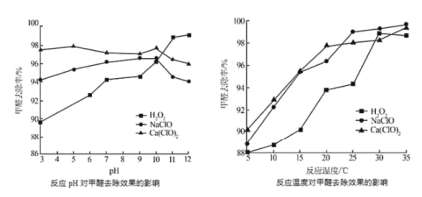
②氧化剂可处理甲醛污染,结合以如图图像分析春季(水温约15℃)应急处理甲醛污染的水源应选择的试剂为________。
(3)750K下,在恒容密闭容器中,充入的甲醇,发生反应:CH3OH(g)HCHO(g) + H2(g),若起始压强为101kPa, 达到平衡转化率为50.0%, 则反应平衡的常数Kp= ______。(用平衡分压代替平衡农度计算,分压=总压×物质的量分数,忽略其它反应)。
【答案】CH3OH (g)=HCHO (g)+H2 (g) △H= +84kJ/mol > BC HCHO-4e- + H2O= CO2+ 4H+ Ca(ClO)2 50.5kPa
【解析】
(1)①焓变=正反应活化能-逆反应活化能,所以CH3OH(g)=HCHO(g)+H2(g)的△H=463 kJ/mol-379 kJ/mol=+84kJ/mol;
②据图可知过程Ⅰ的反应活化能大于过程II;
③A.由图可知,甲醇转化率大于相应温度时甲醇转化为甲醛的转化率,所以甲醇脱氢法制备甲醛过程有副反应发生,故A错误;
B.甲醇脱氢制备甲醛反应焓变大于0,正反应为吸热反应,温度升高平衡正向移动,甲醇生成甲醛的转化率应增大,而实际上温度高于650℃时甲醇转化为甲醛的转化率降低,说明该反应的催化剂活性降低,故B正确;
C.及时分离产品,降低生成物浓度,有利于平衡正向移动,有利于提高甲醇生成甲醛的转化率,故C正确;
故答案为:BC;
(2)①由传感器工作原理图可知,HCHO发生氧化反应生成CO2,电极b为负极,电解质溶液显酸性,所以电极反应式为HCHO-4e-+H2O=CO2+4H+;
②由图可知,温度低于22℃时,Ca(ClO)2处理甲醛污染水源的去除率高,温度高于22℃时,NaClO处理甲醛污染水源的去除率高,春季水温约15℃,所以选择Ca(ClO)2处理甲醛污染的水源;
(3)恒容密闭容器中气体压强之比等于气体的物质的量之比,初始投料为甲醇,起始压强为101kPa,不妨设初始投料为101mol甲醇,平衡转化率为50.0%,则列三段式有:

所以平衡时p(CH3OH)= p(HCHO)=p(H2)=50.5=kPa,Kp=![]() =50.5kPa。
=50.5kPa。

【题目】钒具有广泛用途。黏土钒矿中,钒以+3、+4、+5价的化合物存在,还包括钾、镁的铝硅酸盐,以及SiO2、Fe3O4。采用以下工艺流程可由黏土钒矿制备NH4VO3。
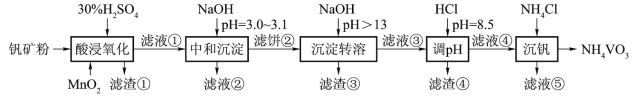
该工艺条件下,溶液中金属离子开始沉淀和完全沉淀的pH如下表所示:
金属离子 | Fe3+ | Fe2+ | Al3+ | Mn2+ |
开始沉淀pH | 1.9 | 7.0 | 3.0 | 8.1 |
完全沉淀pH | 3.2 | 9.0 | 4.7 | 10.1 |
回答下列问题:
(1)“酸浸氧化”需要加热,其原因是___________。
(2)“酸浸氧化”中,VO+和VO2+被氧化成![]() ,同时还有___________离子被氧化。写出VO+转化为
,同时还有___________离子被氧化。写出VO+转化为![]() 反应的离子方程式___________。
反应的离子方程式___________。
(3)“中和沉淀”中,钒水解并沉淀为![]() ,随滤液②可除去金属离子K+、Mg2+、Na+、___________,以及部分的___________。
,随滤液②可除去金属离子K+、Mg2+、Na+、___________,以及部分的___________。
(4)“沉淀转溶”中,![]() 转化为钒酸盐溶解。滤渣③的主要成分是___________。
转化为钒酸盐溶解。滤渣③的主要成分是___________。
(5)“调pH”中有沉淀生产,生成沉淀反应的化学方程式是___________。
(6)“沉钒”中析出NH4VO3晶体时,需要加入过量NH4Cl,其原因是___________。
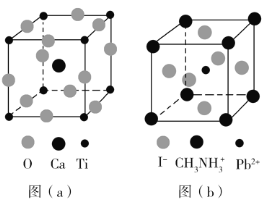
【题目】钙钛矿(CaTiO3)型化合物是一类可用于生产太阳能电池、传感器、固体电阻器等的功能材料,回答下列问题:
(1)基态Ti原子的核外电子排布式为____________。
(2)Ti的四卤化物熔点如下表所示,TiF4熔点高于其他三种卤化物,自TiCl4至TiI4熔点依次升高,原因是____________。
化合物 | TiF4 | TiCl4 | TiBr4 | TiI4 |
熔点/℃ | 377 | ﹣24.12 | 38.3 | 155 |
(3)CaTiO3的晶胞如图(a)所示,其组成元素的电负性大小顺序是__________;金属离子与氧离子间的作用力为__________,Ca2+的配位数是__________。
(4)一种立方钙钛矿结构的金属卤化物光电材料的组成为Pb2+、I﹣和有机碱离子![]() ,其晶胞如图(b)所示。其中Pb2+与图(a)中__________的空间位置相同,有机碱
,其晶胞如图(b)所示。其中Pb2+与图(a)中__________的空间位置相同,有机碱![]() 中,N原子的杂化轨道类型是__________;若晶胞参数为a nm,则晶体密度为_________g·cm-3(列出计算式)。
中,N原子的杂化轨道类型是__________;若晶胞参数为a nm,则晶体密度为_________g·cm-3(列出计算式)。
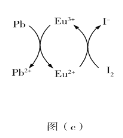
(5)用上述金属卤化物光电材料制作的太阳能电池在使用过程中会产生单质铅和碘,降低了器件效率和使用寿命。我国科学家巧妙地在此材料中引入稀土铕(Eu)盐,提升了太阳能电池的效率和使用寿命,其作用原理如图(c)所示,用离子方程式表示该原理_______、_______。