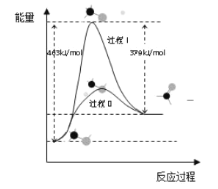
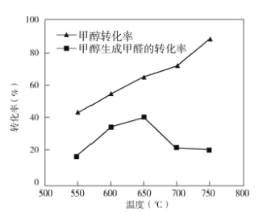
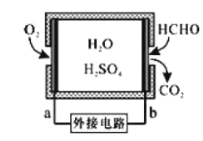
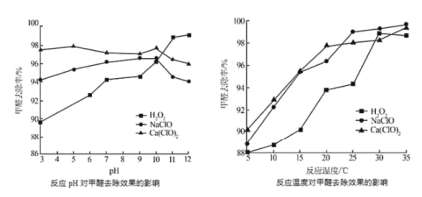
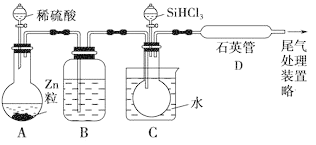
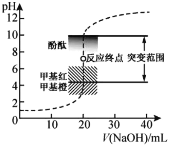
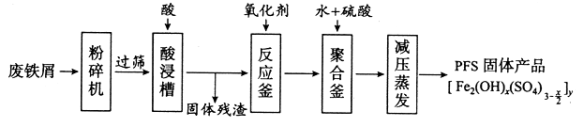
题目内容
【题目】元素A的阳离子![]() 与元素B的阴离子
与元素B的阴离子![]() 具有相同的电子层结构。以下关于A、B元素性质的比较正确的是
具有相同的电子层结构。以下关于A、B元素性质的比较正确的是
A.原子序数:![]() B.离子半径:Am+>Bn-
B.离子半径:Am+>Bn-
C.原子半径:![]() D.
D.![]()
【答案】A
【解析】
元素A的阳离子![]() 与元素B的阴离子
与元素B的阴离子![]() 具有相同的电子层结构,则有
具有相同的电子层结构,则有![]() ,则有
,则有![]() ,A位于B的下一周期,根据在周期表中的位置比较原子半径,电子层结构相同核电核数越大离子半径越小。
,A位于B的下一周期,根据在周期表中的位置比较原子半径,电子层结构相同核电核数越大离子半径越小。
A. 元素A的阳离子![]() 与元素B的阴离子
与元素B的阴离子![]() 具有相同的电子层结构,则有
具有相同的电子层结构,则有![]() ,则有
,则有![]() ,故A正确;
,故A正确;
B. 电子层结构相同核电核数越大离子半径越小,则离子半径:![]() ,故B错误;
,故B错误;
C. A位于B的下一周期,则原子半径:![]() ,故C错误;
,故C错误;
D. 元素A的阳离子![]() 与元素B的阴离子
与元素B的阴离子![]() 具有相同的电子层结构,则
具有相同的电子层结构,则![]() ,即
,即![]() ,故D错误。
,故D错误。
综上所述,答案为A。

 数学奥赛暑假天天练南京大学出版社系列答案
数学奥赛暑假天天练南京大学出版社系列答案 南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案
南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案【题目】(1)氮化硼、氮化铝、氮化镓的结构类似于金刚石,熔点如表中所示:
物质 | BN | AIN | GaN |
熔点/℃ | 3000 | 2200 | 1700 |
试从结构的角度分析它们熔点不同的原因___________________________________。
(2)N、P、As位于同一主族,基态氮原子的核外共有________种不同运动状态的电子,与PO43-互为等电子体的分子有________________(填一种即可)。
(3)铬原子的最高能层符号是_______,其价电子轨道表示式为____________________。
(4)比较第二电离能Cu_______Zn(填“>”、“=”、“<")。
(5)AuCl3是一种褐红色晶体,吸湿性极强,易溶于水和乙醇,无论是固态、还是气态,它都是以二聚体Au2Cl6的形式存在。写出Au2Cl6的结构式__________________________.
(6)已知Zn2+、Au+均能与CN-形成配离子, Zn2+与CN-形成的配离子为正四面体形,Au+与CN-形成的配离子为直线形. 工业上常用Au+和CN-形成的配离子与Zn单质反应来提取Au单质,写出该反应的离子方程式___________________________________________________________________________________ 。