题目内容
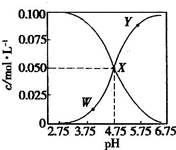 25℃,有c(CH3COOH)+c(CH3COO-)=0.1mol?L-1的一组醋酸和醋酸钠混合溶液,溶液中c(CH3COOH)、c(CH3COO-)与pH的关系如图所示.下列有关离子浓度关系的叙述中正确的是( )
25℃,有c(CH3COOH)+c(CH3COO-)=0.1mol?L-1的一组醋酸和醋酸钠混合溶液,溶液中c(CH3COOH)、c(CH3COO-)与pH的关系如图所示.下列有关离子浓度关系的叙述中正确的是( )分析:由图象可看出,浓度增大的曲线应为c(CH3COO-),浓度减小的曲线应为c(CH3COOH),W点时c(CH3COOH)=c(CH3COO-),结合溶液的电荷守恒、物料守恒解答该题.
解答:解:A.X点所表示的溶液PH=4.75,所表示的溶液中c(CH3COOH)=c(CH3COO-)=0.05mol/L,根据溶液中电荷守恒为c(Na+)+c(H+)=c(CH3COO-)+c(OH-),得到c(Na+)+c(H+)=c(CH3COOH)+c(OH-),故A错误;
B.c(Na+)+c(H+)=c(CH3COO-)+c(OH-),再把题干中的c(CH3COOH)+c(CH3COO-)=0.1mol?L-1代入即可得c(Na+)+c(H+)-c(OH-)+c(CH3COOH)=0.1mol?L-1,故B错误;
C.x点c(CH3COOH)=c(CH3COO-),平衡常数K=
=10-4.75mol?L-1,故C正确;
D.向X点所表示的溶液中加入等体积的0.05mol?L-1NaOH溶液,则溶液中的溶质是醋酸钠,醋酸钠的浓度是0.1mol/L,由电荷守恒可知,c(Na+)+c(H+)=c(CH3COO-)+c(OH-),根据物料守恒得c(CH3COOH)+c(CH3COO-)=c(Na+),c(OH-)=c(CH3COOH)+c(H+),故D错误;
故选C.
B.c(Na+)+c(H+)=c(CH3COO-)+c(OH-),再把题干中的c(CH3COOH)+c(CH3COO-)=0.1mol?L-1代入即可得c(Na+)+c(H+)-c(OH-)+c(CH3COOH)=0.1mol?L-1,故B错误;
C.x点c(CH3COOH)=c(CH3COO-),平衡常数K=
| c(CH3COO-)c(H+) |
| c(CH3COOH) |
D.向X点所表示的溶液中加入等体积的0.05mol?L-1NaOH溶液,则溶液中的溶质是醋酸钠,醋酸钠的浓度是0.1mol/L,由电荷守恒可知,c(Na+)+c(H+)=c(CH3COO-)+c(OH-),根据物料守恒得c(CH3COOH)+c(CH3COO-)=c(Na+),c(OH-)=c(CH3COOH)+c(H+),故D错误;
故选C.
点评:本题属于基本概念与理论的考查,涉及水解与电离平衡、物料守恒和电荷守恒、离子浓度大小比较,溶液中存在水解与电离两个过程的离子浓度大小比较似乎是考试热点内容,学习中要反复加强训练,题目难度中等.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案 目标测试系列答案
目标测试系列答案
相关题目






 ②IBr+KI=I2+KBr
③I2+2S2O32-=2I-+S4O62-
②IBr+KI=I2+KBr
③I2+2S2O32-=2I-+S4O62-