题目内容
12.制烧碱所用盐水需两次精制.第一次精制主要是用沉淀法除去粗盐水中Ca2+、Mg2+、SO42-等离子,过程如下:Ⅰ.向粗盐水中加入过量BaCl2溶液,过滤;
Ⅱ.向所得滤液中加入过量Na2CO3溶液,过滤;
Ⅲ.滤液用盐酸调节pH,获得第一次精制盐水.
(1)过程Ⅰ除去的离子是SO42-.
(2)过程Ⅰ、Ⅱ生成的部分沉淀及其溶解度(20℃/g)如下表,请依据表中数据解释下列问题:
CaSO4 Mg2(OH)2CO3 CaCO3 BaSO4 BaCO3.
2.6×10-2 2.5×10-4 7.8×10-4 2.4×10-4 1.7×10-3
①过程Ⅰ选用BaCl2而不选用CaCl2的原因为BaSO4的溶解度比CaSO4的小,可将SO42-沉淀更完全.
②过程II之后检测Ca2+、Mg2+及过量Ba2+是否除尽时,只需检测Ba2+即可,原因是在BaCO3、CaCO3、Mg2(OH)2CO3中,BaCO3的溶解度最大,若Ba2+沉淀完全,则说明Mg2+ 和Ca2+也沉淀完全.
(3)第二次精制要除去微量的I-、IO3-、NH4+、Ca2+、Mg2+,流程示意如下:
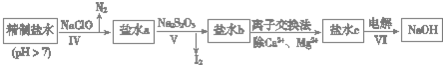
①过程Ⅳ除去的离子有NH4+、I-.
②盐水b中含有SO42-.Na2S2O3将IO3-还原为I2的离子方程式是5S2O32-+8IO3-+2OH-=4I2+10SO42-+H2O.
③过程VI中,产品NaOH在电解槽的阴极区生成(填“阳极”或“阴极”),该电解槽为阳离子交换膜电解槽(填“阳”或“阴”).
分析 (1)根据氯化钡能够与硫酸根离子反应生成硫酸钡进行解答;
(2)①根据表中数据分析BaSO4与CaSO4的溶解度大小,溶解度越小,沉淀越完全;
②根据BaCO3、CaCO3、Mg2(OH)2CO3 的溶解度进行分析;
(3)①次氯酸根离子具有强氧化性,能够氧化铵根离子和碘离子;
②Na2S2O3具有还原性,能够与碘酸根离子发生氧化还原反应,同时被氧化成硫酸根离子,据此写出反应的离子方程式;
③电解饱和食盐水在阴极区得NaOH和H2,在阳极区得Cl2.
解答 解:(1)加入过量BaCl2溶液能除去粗盐水中的SO42-;故答案为:SO42-;
(2)①由于BaSO4的溶解度比CaSO4的小,用CaCl2不能将SO42-沉淀完全,故选用BaCl2才能将其除尽;
故答案为:BaSO4的溶解度比CaSO4的小,可将SO42-沉淀更完全;
②在BaCO3、CaCO3、Mg2(OH)2CO3等沉淀中,BaCO3的溶解度相对最大,若Ba2+沉淀完全,则说明Mg2+ 和Ca2+也沉淀完全;
故答案为:在BaCO3、CaCO3、Mg2(OH)2CO3中,BaCO3的溶解度最大,若Ba2+沉淀完全,则说明Mg2+ 和Ca2+也沉淀完全;
(3)①NaClO有强氧化性能将NH4+、I-等分别氧化为N2、IO3- 除去;
故答案为:NH4+、I-;
②据题意首先根据得失电子守恒有5S2O32-+8IO3-+2OH---4I2+10SO42-+H2O,再根据电荷守恒有5S2O32-+8IO3-+2OH---4I2+10SO42-+H2O,最后根据原子守恒得5S2O32-+8IO3-+2OH-=4I2+10SO42-+H2O;
故答案为:5S2O32-+8IO3-+2OH-=4I2+10SO42-+H2O;
③电解饱和食盐水在阴极区得NaOH和H2,在阳极区得Cl2,用阳离子交换膜(只允许阳离子通过、阴离子和气体不能通过)能阻止Cl2与NaOH、H2混合反应;
故答案为:阴极;阳.
点评 本题考查了粗盐的提纯、难溶电解质的沉淀平衡及转化、电解原理、离子方程式的书写等知识,题目难度中等,试题涉及的题量较大,知识点较多,注意掌握粗盐的提纯方法、物质的分离与提纯原则,明确电解原理及应用方法,能够正确书写离子方程式.

| A. | 和水中的杂质反应,生成沉淀 | |
| B. | Al3+和Fe3+都有吸附杂质使之沉淀的能力 | |
| C. | 使杂质变成泡沫而除去 | |
| D. | 生成氢氧化铝、氢氧化铁胶体,吸附水中杂质使之沉淀 |
| A. | 按系统命名法,化合物 的名称为:2-甲基-2-乙基丙烷 的名称为:2-甲基-2-乙基丙烷 | |
| B. | 右图是某有机物分子的比例模型,该物质可能是一种氨基酸 | |
| C. | 能用新制氢氧化铜鉴别甘油、葡萄糖溶液、甲酸钠溶液 | |
| D. | 木糖醇( )和葡萄糖( )和葡萄糖( ),互为同系物,均属于糖类 ),互为同系物,均属于糖类 |
| A. | 400mL | B. | 450 mL | C. | 500 mL | D. | 不能确定 |
| A. | C3H8O | B. | CH2O | C. | C2H4Cl2 | D. | C4H8O2 |
| A. | 1 mol的 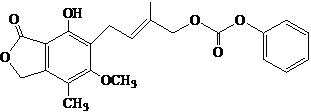 最多能与含5.0 mol NaOH的水溶液完全反应 最多能与含5.0 mol NaOH的水溶液完全反应 | |
| B. | 常压下,邻二甲苯、间二甲苯、对二甲苯的沸点依次增大 | |
| C. | 肌醇  与葡萄糖 与葡萄糖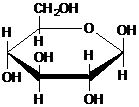 的元素组成相同,化学式均为C6H12O6,满足Cm(H2O)n,因此,均属于糖类化合物 的元素组成相同,化学式均为C6H12O6,满足Cm(H2O)n,因此,均属于糖类化合物 | |
| D. | C3H8的所有碳原子一定在同一平面上 |
| A. | 阿司匹林肠溶片具有较强的解热镇痛和抗炎、抗风湿效用,它能防止药物对胃的刺激 | |
| B. | “胃舒平”是抗酸药,主要用于治疗胃酸分泌过多的疾病,长期服用无任何副作用 | |
| C. | 青霉素是一种天然抗生素,对人体细胞的毒性很低,对病毒引起的疾病有良好的疗效 | |
| D. | 药物作用于人体,除了有治疗功效外,还可能引起不良反应,但不会危害人体健康 |
①Al ②AlCl3 ③Na[Al(OH)4]④Al(OH)3 ⑤Al2O3.
| A. | ①②③④⑤ | B. | ①③④⑤ | C. | ④⑤ | D. | ①④⑤ |
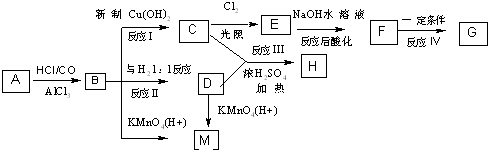
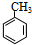 、M
、M ;
; ;C+D→H:
;C+D→H: .
.