题目内容
(2009?兖州市模拟)盐酸、硫酸和硝酸是中学阶段常见的“三大酸”.请就“三大酸”与金属铜的反应情况,回答下列问题:
(1)①在100mL 18mol/L的浓硫酸中加入过量的铜片,加热使之充分反应,产生的气体在标准状况下的体积可能是
A.40.32L B.30.24L C.20.16L D.6.72L
②有同学提出,若使上述反应①中剩余的铜片继续溶解,可向其中加入硝酸钠,请判断该方案是否可行?
(2)若将过量铜粉与一定量浓硝酸反应,当反应完全停止时,共收集到的气体1.12L(标准状况),则该气体的成分是
A.0.1mol B.0.15mol C.0.2mol D.0.25mol
(3)①甲同学向浸泡铜片的稀盐酸中加入H2O2后,铜片溶解,并且该反应的产物只有氯化铜和水.则在该反应中,H2O2的作用是
②乙同学提出,设计一个常见的实验装置,在一定条件下,不需再外加化学试剂,就能将铜溶解在盐酸中.请写出该反应的化学方程式:
 .
.
(1)①在100mL 18mol/L的浓硫酸中加入过量的铜片,加热使之充分反应,产生的气体在标准状况下的体积可能是
D
D
A.40.32L B.30.24L C.20.16L D.6.72L
②有同学提出,若使上述反应①中剩余的铜片继续溶解,可向其中加入硝酸钠,请判断该方案是否可行?
可行
可行
若不可行,请说明原因.若可行,请写出反应的离子方程式3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O
3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O
.(2)若将过量铜粉与一定量浓硝酸反应,当反应完全停止时,共收集到的气体1.12L(标准状况),则该气体的成分是
NO2、NO
NO2、NO
.则反应中所消耗的硝酸的物质的量可能为B
B
A.0.1mol B.0.15mol C.0.2mol D.0.25mol
(3)①甲同学向浸泡铜片的稀盐酸中加入H2O2后,铜片溶解,并且该反应的产物只有氯化铜和水.则在该反应中,H2O2的作用是
氧化
氧化
剂,该反应的化学方程式为Cu+H2O2+2HCl=CuCl2+2H2O
Cu+H2O2+2HCl=CuCl2+2H2O
.②乙同学提出,设计一个常见的实验装置,在一定条件下,不需再外加化学试剂,就能将铜溶解在盐酸中.请写出该反应的化学方程式:
Cu+2HCl
CuCl2+H2↑
| ||
Cu+2HCl
CuCl2+H2↑
,画出相应的装置图并指明电极材料
| ||


分析:(1)①根据铜只能和浓硫酸反应和稀硫酸不反应的性质判断;
②根据在酸性条件下,NO3-具有强氧化性,能与Cu发生氧化还原反应的性质分析;
(2)过量铜粉与一定量浓硝酸反应,反应开始是生成NO2,发生:Cu+4HNO3=Cu(NO3)2+2NO2↑+2H2O;随着反应的进行,硝酸浓度降低,稀硝酸与铜反应生成NO,
发生:3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O;
(3)①盐酸不能与金属铜反应,但可以与氧化铜反应,所以双氧水的作用是将金属铜氧化为CuO,然后氧化铜溶于盐酸;
②设计电解池,令金属铜作阳极,盐酸为电解质溶液,发生反应为:Cu+2HCl
CuCl2+H2↑.
②根据在酸性条件下,NO3-具有强氧化性,能与Cu发生氧化还原反应的性质分析;
(2)过量铜粉与一定量浓硝酸反应,反应开始是生成NO2,发生:Cu+4HNO3=Cu(NO3)2+2NO2↑+2H2O;随着反应的进行,硝酸浓度降低,稀硝酸与铜反应生成NO,
发生:3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O;
(3)①盐酸不能与金属铜反应,但可以与氧化铜反应,所以双氧水的作用是将金属铜氧化为CuO,然后氧化铜溶于盐酸;
②设计电解池,令金属铜作阳极,盐酸为电解质溶液,发生反应为:Cu+2HCl
| ||
解答:解:(1)①铜只能和浓硫酸反应和稀硫酸不反应,Cu+2H2SO4(浓)
CuSO4+SO2↑+H2O,浓硫酸的物质的量为0.1L×18mol/L=1.8mol,如被还原的硫酸是0.9mol,
则生成n(SO2)=0.9mol,V(SO2)=0.9mol×22.4L/mol=20.16L,但随着铜和浓硫酸的反应的进行,酸的浓度越来越小,不再产生二氧化硫,则生成二氧化硫的体积小于20.16L,
只有D符合,故答案为D;
②若使剩余的铜片继续溶解,可向其中加入硝酸盐,溶液中有H+,再加入硝酸盐引入NO3-,在酸性条件下,NO3-具有强氧化性,能与Cu发生氧化还原反应,
反应为3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O,
故答案为:可行;3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O;
(2)过量铜粉与一定量浓硝酸反应,反应开始是生成NO2,发生:Cu+4HNO3=Cu(NO3)2+2NO2↑+2H2O;随着反应的进行,硝酸浓度降低,稀硝酸与铜反应生成NO,
发生:3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O;
气体的物质的量为
=0.05mol,
当生成气体全部为NO2时,消耗的硝酸的物质的量为0.05mol×2=0.10mol,
当生成气体全部为NO时,消耗的硝酸的物质的量为0.05mol×4=0.20mol,所以消耗的硝酸的物质的量介于0.10mol和0.20mol之间,只有B符合,
故答案为:NO2、NO;B;
(3)①盐酸不能与金属铜反应,但可以与氧化铜反应,所以双氧水的作用是将金属铜氧化为CuO,然后氧化铜溶于盐酸,反应的方程式为Cu+H2O2+2HCl=CuCl2+2H2O,
故答案为:氧化;Cu+H2O2+2HCl=CuCl2+2H2O;
②若要设计实验,使金属铜溶于盐酸,可设计原电池,令金属铜作负极,发生吸氧腐蚀,但这一过程比较缓慢,也可以设计电解池,令金属铜作阳极,盐酸为电解质溶液,
发生反应为:Cu+2HCl
CuCl2+H2↑,从而得出实验图 ,
,
故答案为:Cu+2HCl
CuCl2+H2↑; .
.
| ||
则生成n(SO2)=0.9mol,V(SO2)=0.9mol×22.4L/mol=20.16L,但随着铜和浓硫酸的反应的进行,酸的浓度越来越小,不再产生二氧化硫,则生成二氧化硫的体积小于20.16L,
只有D符合,故答案为D;
②若使剩余的铜片继续溶解,可向其中加入硝酸盐,溶液中有H+,再加入硝酸盐引入NO3-,在酸性条件下,NO3-具有强氧化性,能与Cu发生氧化还原反应,
反应为3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O,
故答案为:可行;3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O;
(2)过量铜粉与一定量浓硝酸反应,反应开始是生成NO2,发生:Cu+4HNO3=Cu(NO3)2+2NO2↑+2H2O;随着反应的进行,硝酸浓度降低,稀硝酸与铜反应生成NO,
发生:3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O;
气体的物质的量为
| 1.12L |
| 22.4L/mol |
当生成气体全部为NO2时,消耗的硝酸的物质的量为0.05mol×2=0.10mol,
当生成气体全部为NO时,消耗的硝酸的物质的量为0.05mol×4=0.20mol,所以消耗的硝酸的物质的量介于0.10mol和0.20mol之间,只有B符合,
故答案为:NO2、NO;B;
(3)①盐酸不能与金属铜反应,但可以与氧化铜反应,所以双氧水的作用是将金属铜氧化为CuO,然后氧化铜溶于盐酸,反应的方程式为Cu+H2O2+2HCl=CuCl2+2H2O,
故答案为:氧化;Cu+H2O2+2HCl=CuCl2+2H2O;
②若要设计实验,使金属铜溶于盐酸,可设计原电池,令金属铜作负极,发生吸氧腐蚀,但这一过程比较缓慢,也可以设计电解池,令金属铜作阳极,盐酸为电解质溶液,
发生反应为:Cu+2HCl
| ||
 ,
,故答案为:Cu+2HCl
| ||
 .
.点评:本题考查硝酸和硫酸的性质,题目难度中等,本题注意易忽视的几个问题①铜只能和浓硫酸反应;②在酸性条件下,NO3-具有强氧化性③过量铜粉与一定量浓硝酸反应,反应开始是生成NO2,稀硝酸与铜反应生成NO,④设计电解池,令金属铜作阳极,盐酸为电解质溶液.

练习册系列答案
相关题目
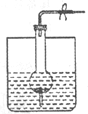 (2009?兖州市模拟)如图是制取气体的一种装置,不能用此“随开随用,随关随停”装置制取气体的是( )
(2009?兖州市模拟)如图是制取气体的一种装置,不能用此“随开随用,随关随停”装置制取气体的是( )
 (2009?兖州市模拟)为了减少污染,使实验绿色化,微型实验备受青睐,下列操作是某学生做的一个微型实验:在一块下衬白纸的玻璃片的不同位置分别滴加浓度为0.1mol/L的KBr、KI(含淀粉溶液)、NaOH(含酚酞)、FeSO4(含KSCN)溶液各l滴,每种液滴彼此分开,围成半径小于表面皿的圆形(如图所示),在圆心处放置2粒芝麻大小的KClO3晶体,盖好表面皿.打开表面皿,向KClO3晶体滴加一滴浓盐酸(氯酸钾与浓盐酸反应:ClO3-+6H++5Cl-=3Cl2↑+3H2O),再立即将表面皿盖好,试描述各处反应的现象,并写出相应的离子反应方程式.
(2009?兖州市模拟)为了减少污染,使实验绿色化,微型实验备受青睐,下列操作是某学生做的一个微型实验:在一块下衬白纸的玻璃片的不同位置分别滴加浓度为0.1mol/L的KBr、KI(含淀粉溶液)、NaOH(含酚酞)、FeSO4(含KSCN)溶液各l滴,每种液滴彼此分开,围成半径小于表面皿的圆形(如图所示),在圆心处放置2粒芝麻大小的KClO3晶体,盖好表面皿.打开表面皿,向KClO3晶体滴加一滴浓盐酸(氯酸钾与浓盐酸反应:ClO3-+6H++5Cl-=3Cl2↑+3H2O),再立即将表面皿盖好,试描述各处反应的现象,并写出相应的离子反应方程式.