题目内容
)单晶硅是信息产业中重要的基础材料。工业上可用焦炭与二氧化硅的混合物在高温下与氯气反应生成SiCl4和CO,SiCl4经提纯后用氢气还原得高纯硅。以下是实验室制备SiCl4的装置示意图。
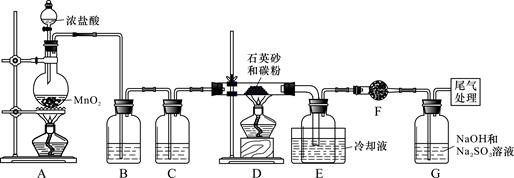
实验过程中,石英砂中的铁、铝等杂质也能转化为相应氯化物,SiCl4、AlCl3、FeCl3遇水均易水解,有关物质的物理常数见下表:
请回答下列问题:
(1)写出装置A中发生反应的离子方程式:_____________, 装置D的硬质玻璃管中发生反应的化学方程式是 。
(2)装置C中的试剂是 ; D、E间导管短且粗的原因是 。
(3)G中吸收尾气一段时间后,吸收液中肯定存在OH-、Cl-和SO42-。请设计实验,探究该吸收液中可能存在的其他酸根离子(忽略空气中CO2的影响)。
【提出假设】假设1:只有SO32-;假设2:既无SO32-也无ClO-;假设3: 。
【设计方案,进行实验】可供选择的实验试剂有:3 mol/L H2SO4、1 mol/L NaOH、0.01 mol/L KMnO4、溴水、淀粉-KI、品红等溶液。
取少量吸收液于试管中,滴加3 mol/L H2SO4至溶液呈酸性,然后将所得溶液分置于a、b、c三支试管中,分别进行下列实验。请完成下表:

实验过程中,石英砂中的铁、铝等杂质也能转化为相应氯化物,SiCl4、AlCl3、FeCl3遇水均易水解,有关物质的物理常数见下表:
| 物质 | SiCl4 | AlCl3 | FeCl3 |
| 沸点/℃ | 57.7 | - | 315 |
| 熔点/℃ | -70.0 | - | - |
| 升华温度/℃ | - | 180 | 300 |
请回答下列问题:
(1)写出装置A中发生反应的离子方程式:_____________, 装置D的硬质玻璃管中发生反应的化学方程式是 。
(2)装置C中的试剂是 ; D、E间导管短且粗的原因是 。
(3)G中吸收尾气一段时间后,吸收液中肯定存在OH-、Cl-和SO42-。请设计实验,探究该吸收液中可能存在的其他酸根离子(忽略空气中CO2的影响)。
【提出假设】假设1:只有SO32-;假设2:既无SO32-也无ClO-;假设3: 。
【设计方案,进行实验】可供选择的实验试剂有:3 mol/L H2SO4、1 mol/L NaOH、0.01 mol/L KMnO4、溴水、淀粉-KI、品红等溶液。
取少量吸收液于试管中,滴加3 mol/L H2SO4至溶液呈酸性,然后将所得溶液分置于a、b、c三支试管中,分别进行下列实验。请完成下表:
| 序号 | 操 作 | 可能出现的现象 | 结论 |
| ① | 向a试管中滴加几滴 溶液 | 若溶液褪色 | 则假设1成立 |
| 若溶液不褪色 | 则假设2或3成立 | ||
| ② | 向b试管中滴加几滴 溶液 | 若溶液褪色 | 则假设1或3成立 |
| 若溶液不褪色 | 假设2成立 | ||
| ③ | 向c试管中滴加几滴 溶液 | | 假设3成立 |
(1)MnO2+2Cl-+4H+ Mn2++Cl2↑+2H2O ;SiO2+2C+2Cl2
Mn2++Cl2↑+2H2O ;SiO2+2C+2Cl2 SiCl4+2CO
SiCl4+2CO
(2)浓硫酸;防止生成物中的AlCl3、FeCl3等杂质凝结成固体堵塞导管
(3)【提出假设】假设3:只有ClO-
【设计方案,进行实验】①溴水(或0.01 mol/L KMnO4溶液)②品红溶液;③淀粉-KI溶液;若溶液变为蓝色
 Mn2++Cl2↑+2H2O ;SiO2+2C+2Cl2
Mn2++Cl2↑+2H2O ;SiO2+2C+2Cl2 SiCl4+2CO
SiCl4+2CO(2)浓硫酸;防止生成物中的AlCl3、FeCl3等杂质凝结成固体堵塞导管
(3)【提出假设】假设3:只有ClO-
【设计方案,进行实验】①溴水(或0.01 mol/L KMnO4溶液)②品红溶液;③淀粉-KI溶液;若溶液变为蓝色
试题分析:(1)装置A中发生的反应是用高锰酸钾和浓盐水在加热的条件下制备氯气,其反应离子方程式MnO2+2Cl-+4H+
 Mn2++Cl2↑+2H2O;氯气经过除杂后在D中和SiO2与C在加热条件下进行反应生成SiCl4和CO,反应化学方程式SiO2+2C+2Cl2
Mn2++Cl2↑+2H2O;氯气经过除杂后在D中和SiO2与C在加热条件下进行反应生成SiCl4和CO,反应化学方程式SiO2+2C+2Cl2 SiCl4+2CO(2)BC中分别为饱和食盐水和浓硫酸用来除去氯气中的HCl和水蒸气;石英砂中的铁、铝等杂质也能转化为相应氯化物,若导管较细使杂质凝结成固体堵塞导管(3)由假设1和假设2得知,要检测的为SO32-和ClO-,故假设3为只有ClO-;又因为SO32-会使KMnO4和溴水,并不与ClO-发生反应,故可以用来检测假设1,而均SO32-和ClO-具有漂白性,会使品红溶液褪色,故可以用来检测假设2;所有试剂中ClO-可以氧化KI使其生成I2,在淀粉溶液中显蓝色,可以用来检测假设3。
SiCl4+2CO(2)BC中分别为饱和食盐水和浓硫酸用来除去氯气中的HCl和水蒸气;石英砂中的铁、铝等杂质也能转化为相应氯化物,若导管较细使杂质凝结成固体堵塞导管(3)由假设1和假设2得知,要检测的为SO32-和ClO-,故假设3为只有ClO-;又因为SO32-会使KMnO4和溴水,并不与ClO-发生反应,故可以用来检测假设1,而均SO32-和ClO-具有漂白性,会使品红溶液褪色,故可以用来检测假设2;所有试剂中ClO-可以氧化KI使其生成I2,在淀粉溶液中显蓝色,可以用来检测假设3。
练习册系列答案
 学业测评一课一测系列答案
学业测评一课一测系列答案
相关题目
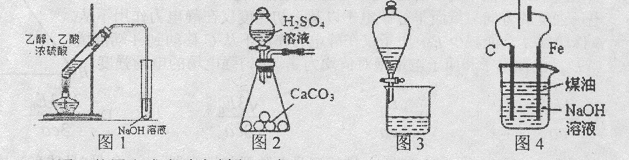
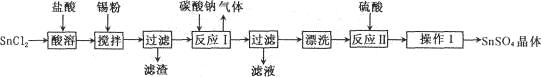
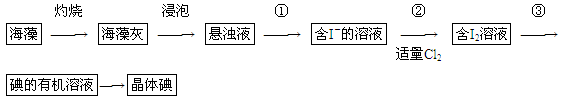 (1)实验操作③的名称是________,所用主要仪器名称为________。
(1)实验操作③的名称是________,所用主要仪器名称为________。
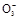 、S
、S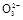 、S
、S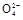 离子中的若干种组成,陶宝同学设计实验检验其组成,记录如下:
离子中的若干种组成,陶宝同学设计实验检验其组成,记录如下: