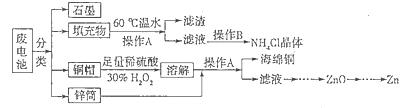
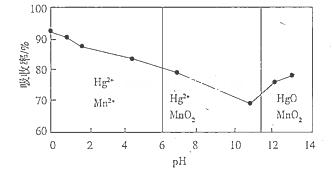
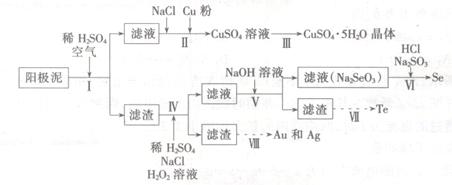
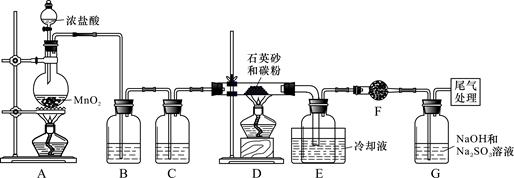
��Ŀ����
��������(SnSO4)��һ����Ҫ��������ˮ�������Σ��㷺Ӧ���ڶ�����ҵ��ij�о�С��
���SnSO4�Ʊ�·�����£�

�������ϣ�
I�����������£�����ˮ��Һ����Sn2+��Sn4+������Ҫ������ʽ��Sn2+�ױ�������
��SnC12��ˮ�����ɼ�ʽ�Ȼ�����[Sn(OH)Cl]
�ش��������⣺
��1������l�IJ���Ϊ ____��____�����ˡ�ϴ�ӡ�����Գ�������ϴ�ӵķ�����_____________��
��2�� SnCl2��ĩ���Ũ��������ܽ⣬���ϱ�Ҫ�Ļ�ѧ����ʽ��ƽ���ƶ�ԭ������ԭ��________��
��3������Sn�۵��������������ٵ�����ҺpH;��__________��
��4�����������£�SnSO4����������˫��ˮȥ������������Ӧ�����ӷ���ʽ�ǣ�________________��
��5����С��ͨ�����з����ⶨ�������۵Ĵ��ȣ����ʲ����뷴Ӧ����ȡag�������������У������ɵ�SnC12�м��������FeC13��Һ����b mol/LK2Cr2O7�ζ����ɵ�Fe2+����֪���Ի����£�Cr2O72-�ɱ���ԭΪCr3+��������ȥK2Cr2O7��Һm ml������������������������________����Sn��Ħ������ΪM g/mol���ú�a��b��m��M�Ĵ���ʽ��ʾ��
���SnSO4�Ʊ�·�����£�

�������ϣ�
I�����������£�����ˮ��Һ����Sn2+��Sn4+������Ҫ������ʽ��Sn2+�ױ�������
��SnC12��ˮ�����ɼ�ʽ�Ȼ�����[Sn(OH)Cl]
�ش��������⣺
��1������l�IJ���Ϊ ____��____�����ˡ�ϴ�ӡ�����Գ�������ϴ�ӵķ�����_____________��
��2�� SnCl2��ĩ���Ũ��������ܽ⣬���ϱ�Ҫ�Ļ�ѧ����ʽ��ƽ���ƶ�ԭ������ԭ��________��
��3������Sn�۵��������������ٵ�����ҺpH;��__________��
��4�����������£�SnSO4����������˫��ˮȥ������������Ӧ�����ӷ���ʽ�ǣ�________________��
��5����С��ͨ�����з����ⶨ�������۵Ĵ��ȣ����ʲ����뷴Ӧ����ȡag�������������У������ɵ�SnC12�м��������FeC13��Һ����b mol/LK2Cr2O7�ζ����ɵ�Fe2+����֪���Ի����£�Cr2O72-�ɱ���ԭΪCr3+��������ȥK2Cr2O7��Һm ml������������������������________����Sn��Ħ������ΪM g/mol���ú�a��b��m��M�Ĵ���ʽ��ʾ��
��1������Ũ������ȴ�ᾧ������������©���У�������ˮ��û������ʹˮ��Ȼ���£��ظ�����2-3��
��2��SnCl2 + H2O
 Sn(OH)Cl + HCl���������ᣬʹ��ƽ�������ƶ�������Sn2+ˮ��
Sn(OH)Cl + HCl���������ᣬʹ��ƽ�������ƶ�������Sn2+ˮ����3����ֹSn2+������
��4��Sn2+ + H2O2 +2H+ = Sn4+ + 2H2O
��5��3bmM /1000a
�����������1������SnSO4���ܽ�����¶ȵ�Ӱ��仯�ϴ����¶ȵ����߶��������¶ȵĽ��Ͷ���С�����Դ�SnSO4��Һ�л��SnSO4����ķ���������Ũ������ȴ�ᾧ��ϴ�ӳ����ķ����ǽ���������©���У�������ˮ��û������ʹˮ��Ȼ���£��ظ�����2-3�Ρ���2�� SnCl2��ĩ���Ũ��������ܽ⣬����ΪSnCl2��ǿ�������Σ���ˮ��������ˮ�ⷴӦSnCl2 + H2O
 Sn(OH)Cl + HCl������HCl���ܽ⣬�����������������Ũ�ȣ�����ʹˮ��ƽ�����淴Ӧ�����ƶ���������SnCl2��ˮ�ⷴӦ�ķ�������3�� ���������������£�����ˮ��Һ����Sn2+��Sn4+������Ҫ������ʽ��Sn2+�ױ����������Լ���Sn�۵��������������ٵ�����ҺpH;�ڷ�ֹSn2+����������5���йط�Ӧ�ķ���ʽΪSn+2HCl=SnCl2+H2����SnCl2+2FeC13=SnCl4+2FeC12�� 6Fe2++Cr2O72-+14H+=6Fe3++2Cr3++7H2O���ɷ���ʽ�ù�ϵʽΪ3Sn����6 FeC12����K2Cr2O7��n(Cr2O72-)=mb��10-3mol.����n(Sn)=3mb��10-3mol.������������������������(3mb��10-3mol��Mg/mol)��ag="3bmM" /1000a.
Sn(OH)Cl + HCl������HCl���ܽ⣬�����������������Ũ�ȣ�����ʹˮ��ƽ�����淴Ӧ�����ƶ���������SnCl2��ˮ�ⷴӦ�ķ�������3�� ���������������£�����ˮ��Һ����Sn2+��Sn4+������Ҫ������ʽ��Sn2+�ױ����������Լ���Sn�۵��������������ٵ�����ҺpH;�ڷ�ֹSn2+����������5���йط�Ӧ�ķ���ʽΪSn+2HCl=SnCl2+H2����SnCl2+2FeC13=SnCl4+2FeC12�� 6Fe2++Cr2O72-+14H+=6Fe3++2Cr3++7H2O���ɷ���ʽ�ù�ϵʽΪ3Sn����6 FeC12����K2Cr2O7��n(Cr2O72-)=mb��10-3mol.����n(Sn)=3mb��10-3mol.������������������������(3mb��10-3mol��Mg/mol)��ag="3bmM" /1000a.
��ϰ��ϵ�д�
 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
�����Ŀ
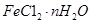 ���������ˮͨ��Ҫͨ�� ��
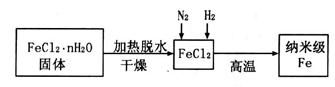
���������ˮͨ��Ҫͨ�� �� ����ͬѧ����ͼ��ʾװ�ý�������Fe����ˮ�����ķ�Ӧ����֤������
����ͬѧ����ͼ��ʾװ�ý�������Fe����ˮ�����ķ�Ӧ����֤������