题目内容
【题目】X、Y、Z、W四种物质的转化关系如图所示。下列组合中不符合该关系的是( )
A | B | C | D | |
X | HCl | Na2O2 | Na2CO3 | SO2 |
Y | FeCl2 | NaOH | CO2 | Na2SO3 |
Z | Cl2 | Na2CO3 | CaCO3 | H2SO4 |
W | FeCl3 | NaHCO3 | Ca(HCO3)2 | NaHSO3 |

A. A B. B C. C D. D
【答案】B
【解析】A.HCl可与Fe反应生成FeCl2,Fe+2HCl=FeCl2+H2↑,盐酸的浓溶液也可以被MnO2氧化生成Cl2,MnO2+4HCl![]() MnCl2+Cl2↑+2H2O,Cl2可与FeCl2反应生成FeCl3,Cl2+2FeCl2=2FeCl3,符合转化关系,故A正确;B.Na2CO3可与酸反应生成CO2,Na2CO3+2HCl=2NaCl+CO2↑+H2O,可与氢氧化钙反应生成CaCO3,Ca(OH)2+CO2=CaCO3↓+H2O,CaCO3与CO2反应生成Ca(HCO3)2,CaCO3+CO2+H2O=Ca(HCO3)2 ,符合转化关系,故B正确;C.Na2O2可与水反应生成NaOH,可与二氧化碳反应生成Na2CO3,Na2CO3与NaOH不反应,故C错误; D.SO2可与NaOH反应生成Na2SO3,SO2+2NaOH=Na2SO3+H2O,与过氧化氢反应生成H2SO4,SO2+H2O2=H2SO4,H2SO4和Na2SO3反应生成NaHSO3,H2SO4+Na2SO3=NaHSO4+NaHSO3 ,故D正确。
MnCl2+Cl2↑+2H2O,Cl2可与FeCl2反应生成FeCl3,Cl2+2FeCl2=2FeCl3,符合转化关系,故A正确;B.Na2CO3可与酸反应生成CO2,Na2CO3+2HCl=2NaCl+CO2↑+H2O,可与氢氧化钙反应生成CaCO3,Ca(OH)2+CO2=CaCO3↓+H2O,CaCO3与CO2反应生成Ca(HCO3)2,CaCO3+CO2+H2O=Ca(HCO3)2 ,符合转化关系,故B正确;C.Na2O2可与水反应生成NaOH,可与二氧化碳反应生成Na2CO3,Na2CO3与NaOH不反应,故C错误; D.SO2可与NaOH反应生成Na2SO3,SO2+2NaOH=Na2SO3+H2O,与过氧化氢反应生成H2SO4,SO2+H2O2=H2SO4,H2SO4和Na2SO3反应生成NaHSO3,H2SO4+Na2SO3=NaHSO4+NaHSO3 ,故D正确。

【题目】(选修三——物质结构与性质)氮和磷元素的单质和化合物在农药生产及工业制造业等领域用途非常广泛,请根据提示回答下列问题:
(l)科学家合成了一种阳离子为“N5n+”、其结构是对称的,5个N排成“V”形,每个N原子都达到8电子稳定结构,且含有2个氮氮三键;此后又合成了一种含有“N5n+”化学式分“N8”的离子晶体,其电子式为__________________,其中的阴离子的空间构型为_________。
(2)2001年德国专家从硫酸钱中检出一种组成为N4H4(SO4)2的物质,经测定,该物质易溶于水,在水中以SO42-和N4H44+两种离子的形式存在。N4H44+根系易吸收,但它遇到碱时会生成类似白磷的N4分子,不能被植物吸收。1个N4H44+中含有______个σ键。
(3)氨(NH3)和膦(PH3)是两种三角锥形气态氢化物,其键角分别为107°和93.6°,试分析PH3的键角小于NH3的原因_________________________。
(4)P4S3可用于制造火柴,其分子结构如图l所示。

①P4S3分子中硫原子的杂化轨道类型为_______。
②每个P4S3分子中含孤电子对的数月为_______。
(5)某种磁性氮化铁的晶胞结构如图2所示,该化合物的化学式为______。若晶胞底边长为a nm,高为c nm,则这种磁性氮化铁的晶体密度为_______g/㎝3(用含a c和NA的式子表示)

(6)高温超导材料,是具有高临界转变温度(Te)能在液氮温度度条件下工作的超导材料。高温超导材料镧钡铜氧化物中含有Cu3+。基态时Cu3+的电子排布式为[Ar]______;化合物中,稀土元素最常见的化合价是+3 ,但也有少数的稀土元素可以显示+4价,观察下面四种稀土元素的电离能数据,判断最有可能显示+4价的稀土元素是_____________。
几种稀土元素的电离能(单位:KJ/mol)
元素 | I1 | I2 | I3 | I4 |
Se(钪) | 633 | 1235 | 2389 | 7019 |
Y(铱) | 616 | 1181 | 1980 | 5963 |
La(镧) | 538 | 1067 | 1850 | 4819 |
Ce(铈) | 527 | 1047 | 1949 | 3547 |
【题目】丙烯酸的结构简式为CH2=CH—COOH,对其性质的描述不正确的是( )
A.能与金属钠反应放出氢气B.能与新制氢氧化铜反应
C.能发生加聚反应生成高分子化合物D.能与溴水发生取代反应而使溴水褪色
【题目】五种短周期元素的部分性质数据如下:
元素 | T | X | Y | Z | W |
原子半径(nm) | 0.037 | 0.075 | 0.099 | 0.102 | 0.143 |
最高或最低化合价 | +1 | +5,-3 | +7,-1 | +6,-2 | +3 |
请回答下列问题:
(1)Z离子的结构示意图为________________。
(2)关于Y、Z两种元素,下列叙述正确的是________(填序号)
a.简单离子的半径Y>Z
b.气态氢化物的稳定性Y比Z强
c.最高价氧化物对应水化物的酸性Z比Y强
(3)甲是由T、X两种元素形成的10e-分子,乙是由Y、W两种元素形成的化合物。
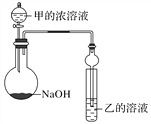
某同学设计了如图所示装置(夹持仪器省略)进行实验,将甲的浓溶液逐滴加入到NaOH固体中,烧瓶中立即有甲放出,原因是______________________。
一段时间后,观察到试管中的现象是______________________________,发生反应的离子方程式是______________________________________________。
(4)XO2是导致光化学烟雾的“罪魁祸首”之一。它被NaOH溶液吸收的化学方程式是:2XO2+2NaOH===M+NaXO3+H2O(已配平),产物M中元素X的化合价为____________________。