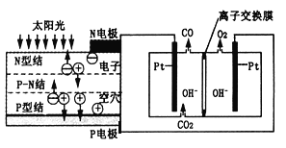
题目内容
【题目】硼酸(H3BO3)为一元弱酸,H3BO3可以通过电解的方法制备。其工作原理如图所示(阳膜和阴膜分别只允许阳离子、阴离子通过)。下列说法错误的是
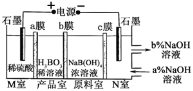
A.b膜为阴离子交换膜
B.阳极的电极反应式为:2H2O-4e- = O2↑+4H+
C.N室中:a%<b%
D.理论上每生成1mol产品,阴极室可生成5.6L(标准状况)气体
【答案】D
【解析】
由题意可知,通过电解NaB(OH)4溶液的方法制备硼酸,右边为阴极室,发生还原反应,2H2O+2e- = H2↑+2OH-,左边为阳极室,发生氧化反应2H2O-4e- = O2↑+4H+。故a为阳离子交换膜,b为阴离子交换膜,c为阳离子交换膜,所以反应后NaOH溶液浓度变大。根据此分析进行解答。
A.由题意可知,b为阴离子交换膜,H+与NaB(OH)4在产品室反应生成硼酸(H3BO3)和水,故A选项正确。
B.阳极室,发生氧化反应2H2O-4e- = O2↑+4H+,故B选项正确。
C.N室中发生还原反应生成OH-,反应以后NaOH溶液浓度变大,故a%<b%,故C选项正确。
D.每生成1mol产品,转移1mol电子,阴极室可生成0.5mol H2,为11.2L(标准状况)气体,故D选项错误。
故答案选D。

练习册系列答案
 新题型全程检测期末冲刺100分系列答案
新题型全程检测期末冲刺100分系列答案
相关题目