题目内容
【题目】某同学以反应2Fe3++2I﹣2Fe2++I2为原理,研究浓度对氧化还原性和平衡移动的影响.实验如图1: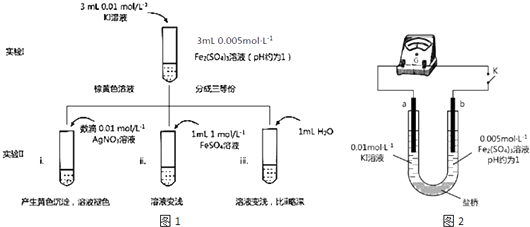
(1)待实验I溶液颜色不再改变时,再进行实验II,目的是使实验I的反应达到 .
(2)iii是ii的对比试验,目的是排除有ii中造成的影响.
(3)i和ii的颜色变化表明平衡逆向移动,Fe2+向Fe3+转化.用化学平衡移动原理解释原因: .
(4)根据氧化还原反应的规律,该同学推测i中Fe2+向Fe3+转化的原 因:外加Ag+使c(I﹣)降低,导致I﹣的还原性弱于Fe2+ , 用图2装置(a、b均为石墨电极)进行实验验证.①K闭合时,指针向右偏转,b作极.
②当指针归零(反应达到平衡)后,向U型管左管滴加0.01molL﹣1 AgNO3溶液,产生的现象证实了其推测,该现象是 .
(5)按照(4)的原理,该同学用右图装置进行实验,证实了ii中Fe2+向Fe3+转化的原因①转化原因是 .
②该实验与(4)实验对比,不同的操作是 .
(6)实验I中,还原性:I﹣>Fe2+;而实验II中,还原性:Fe2+>I﹣ , 将(3)和(4)、(5)作对比,得出的结论是 .
【答案】
(1)化学平衡状态
(2)溶液稀释对颜色变化的影响
(3)加入Ag+发生反应:Ag++I﹣=AgI↓,c(I﹣)降低;或c(Fe2+)增大,平衡均逆向移动
(4)正;左管产生黄色沉淀,指针向左偏转
(5)Fe2+随浓度增大,还原性增强,使Fe2+还原性强于I﹣;向U型管右管中滴加1mol?L﹣1FeSO4溶液
(6)该反应为可逆氧化还原反应,在平衡时,通过改变物质的浓度,可以改变物质的氧化、还原能力,并影响平衡移动方向
【解析】解:(1)待实验I溶液颜色不再改变时,再进行实验II,目的是使实验I的反应达到化学平衡状态,所以答案是:化学平衡状态;(2)根据实验iii和实验ii的对比可以看出是为了排除有ii中水造成溶液中离子浓度改变的影响,所以答案是:溶液稀释对颜色变化的影响;(3)i.加入AgNO3 , Ag+与I﹣生成AgI黄色沉淀,I﹣浓度降低,2Fe3++2I﹣ ![]() 2Fe2++I2平衡逆向移动, ii.加入FeSO4 , Fe2+浓度增大,平衡逆移,
2Fe2++I2平衡逆向移动, ii.加入FeSO4 , Fe2+浓度增大,平衡逆移,
所以答案是:加入Ag+发生反应:Ag++I﹣=AgI↓,c(I﹣)降低;或c(Fe2+)增大,平衡均逆向移动;(4)①K闭合时,指针向右偏转,b极为Fe3+得电子,作正极,所以答案是:正;
②当指针归零(反应达到平衡)后,向U型管左管滴加0.01mol/L AgNO3溶液,产生黄色沉淀,I﹣离子浓度减小,2Fe3++2I﹣ ![]() 2Fe2++I平衡左移,指针向左偏转,所以答案是:左管产生黄色沉淀,指针向左偏转;(5)①Fe2+向Fe3+转化的原因是Fe2+浓度增大,还原性增强,所以答案是:Fe2+随浓度增大,还原性增强,使Fe2+还原性强于I﹣;
2Fe2++I平衡左移,指针向左偏转,所以答案是:左管产生黄色沉淀,指针向左偏转;(5)①Fe2+向Fe3+转化的原因是Fe2+浓度增大,还原性增强,所以答案是:Fe2+随浓度增大,还原性增强,使Fe2+还原性强于I﹣;
②与(4)实验对比,不同的操作是当指针归零后,向U型管右管中滴加1mol/L FeSO4溶液,所以答案是:向U型管右管中滴加1molL﹣1 FeSO4溶液; (6)将(3)和(4)、(5)作对比,得出的结论是在其它条件不变时,物质的氧化性和还原性与浓度有关,浓度的改变可影响物质的氧化还原性,导致平衡移动,所以答案是:该反应为可逆氧化还原反应,在平衡时,通过改变物质的浓度,可以改变物质的氧化、还原能力,并影响平衡移动方向.
【考点精析】根据题目的已知条件,利用化学平衡状态本质及特征的相关知识可以得到问题的答案,需要掌握化学平衡状态的特征:“等”即 V正=V逆>0;“动”即是动态平衡,平衡时反应仍在进行;“定”即反应混合物中各组分百分含量不变;“变”即条件改变,平衡被打破,并在新的条件下建立新的化学平衡;与途径无关,外界条件不变,可逆反应无论是从正反应开始,还是从逆反应开始,都可建立同一平衡状态(等效).

 世纪百通主体课堂小学课时同步达标系列答案
世纪百通主体课堂小学课时同步达标系列答案 世纪百通优练测系列答案
世纪百通优练测系列答案