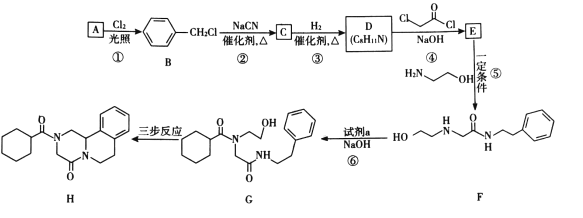
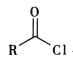
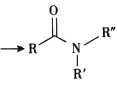
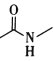
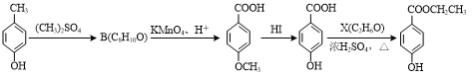
题目内容
【题目】(1)标准状况下,32gCH4和22.4LCO2的密度之比为_______;物质的量之比为______。
(2)将20gNaOH溶于水得2L溶液,则该NaOH溶液的物质的量浓度为_________;若从中取出100mLNaOH溶液,其中含有的Na+与____molNa2CO3含有的Na+数目相同。
(3)已知标准状况下,现有四种物质:
A.49g H2SO4 B.6.02×1023个H2O C.44.8L CO和CO2混合气体 D.6g H2
其中所含分子物质的量最小的是____________(填字母);所占体积最大的是________(填字母);若C中气体重量为64g,则该混合气体中CO和CO2的体积比为__________________。
(4)标准状况下,将aLHCl完全溶于100mL水,假设该溶液的密度为ρ g·mL-1,则所得盐酸溶液中溶质的物质的量为________________,溶液的物质的量浓度为__________。
【答案】4:11 2:1 0.25mol/L 0.0125 A D 3:1 ![]() mol
mol ![]() mol/L
mol/L
【解析】
(1)根据![]() 比较,把物质的质量、体积都转化为物质的量,求比值;
比较,把物质的质量、体积都转化为物质的量,求比值;
(2)根据n=![]() 及c=
及c=![]() 计算溶液的物质的量浓度,利用n=cV计算NaOH溶液中含有的Na+的物质的量,结合Na2CO3的组成确定其物质的量;
计算溶液的物质的量浓度,利用n=cV计算NaOH溶液中含有的Na+的物质的量,结合Na2CO3的组成确定其物质的量;
(3)将选项的物理量都转化为物质的量,然后根据N=nNA判断;假设C中混合气体中CO、CO2的物质的量分别是x、y,根据二者的质量与体积关系计算;
(4)根据n=![]() 计算溶质的物质的量,根据m=ρV计算溶液的质量,结合溶质的质量得到溶液中溶质的质量分数,在利用c=
计算溶质的物质的量,根据m=ρV计算溶液的质量,结合溶质的质量得到溶液中溶质的质量分数,在利用c=![]() 计算溶液的物质的量浓度。
计算溶液的物质的量浓度。
(1)根据![]() 可知CH4和CO2的密度之比等于它们的相对分子质量之比,为16:44=4:11;32gCH4的物质的量为n(CH4)=32g÷16g/mol=2mol,在标准状况下22.4LCO2的物质的量n(CO2)=22.4L÷22.4L/mol=1mol,所以n(CH4):n(CO2)=2mol:1mol=2:1;
可知CH4和CO2的密度之比等于它们的相对分子质量之比,为16:44=4:11;32gCH4的物质的量为n(CH4)=32g÷16g/mol=2mol,在标准状况下22.4LCO2的物质的量n(CO2)=22.4L÷22.4L/mol=1mol,所以n(CH4):n(CO2)=2mol:1mol=2:1;
(2)20gNaOH的物质的量n(NaOH)=![]() =0.5mol,将其溶于水得2L溶液,则该NaOH溶液的物质的量浓度c=
=0.5mol,将其溶于水得2L溶液,则该NaOH溶液的物质的量浓度c=![]() =0.25mol/L;若从中取出100mLNaOH溶液,其中含有的NaOH的物质的量为0.25mol/L×0.1L=0.025mol,根据NaOH的组成可知其中含有的Na+是0.025mol,由于1个Na2CO3电离产生2个Na+。所以Na+为0.025mol,则需Na2CO3的物质的量为0.0125mol;
=0.25mol/L;若从中取出100mLNaOH溶液,其中含有的NaOH的物质的量为0.25mol/L×0.1L=0.025mol,根据NaOH的组成可知其中含有的Na+是0.025mol,由于1个Na2CO3电离产生2个Na+。所以Na+为0.025mol,则需Na2CO3的物质的量为0.0125mol;
A.49g H2SO4的物质的量为n(H2SO4)=49g÷98g/mol=0.5mol;
B.6.02×1023个H2O的物质的量为n(H2O)=6.02×1023 ÷6.02×1023/mol=1mol;
C.44.8L CO和CO2混合气体的物质的量n=44.8L÷22.4L/mol=2mol;
D.6g H2的物质的量n=6g÷2g/mol=3mol
可见物质的量最小的是H2SO4,根据N=nNA可知,物质的量越小,其中含有的分子数目越少,所以其中所含分子物质的量最小的选项是A。在上述物质中,水、硫酸为液体物质,CO和CO2的混合气体及H2都是气体,气体分子间隔大,等物质的量的物质体积也大,则所占体积最大的是H2,选项为D;
假设C中混合气体中CO、CO2的物质的量分别是x mol、y mol,则x+y=2,28x+44y=64,解得x=1.5,y=0.5,则根据V=nVm可知二者的体积比等于它们的物质的量的比,故V(CO):V(CO2)=1.5:0.5=3:1;
(4)标准状况下,aLHCl气体的物质的量n(HCl)=![]() mol,HCl的质量是m(HCl)=nM=
mol,HCl的质量是m(HCl)=nM=![]() mol×36.5g/mol=
mol×36.5g/mol=![]() g;标准状况下,将aLHCl完全溶于100mL水,假设该溶液的密度为ρg·mL-1,溶液的质量是m(溶液)=
g;标准状况下,将aLHCl完全溶于100mL水,假设该溶液的密度为ρg·mL-1,溶液的质量是m(溶液)=![]() g+100g=
g+100g=![]() g,则溶质的质量分数为:
g,则溶质的质量分数为: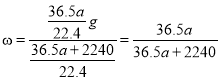 ;则根据物质的量浓度与质量分数换算式可得该盐酸溶液的物质的量浓度c=
;则根据物质的量浓度与质量分数换算式可得该盐酸溶液的物质的量浓度c=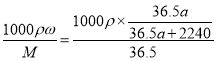 mol/L=
mol/L=![]() mol/L。
mol/L。

【题目】在一定温度下,10 mL 0.40 mol/L H2O2溶液发生催化分解。不同时刻测得生成O2的体积(已折算为标准状况)如下表。
t/min | 0 | 2 | 4 | 6 | 8 | 10 |
V(O2)/mL | 0.0 | 9.9 | 17.2 | 22.4 | 26.5 | 29.9 |
下列叙述不正确的是(溶液体积变化忽略不计)( )
A. 0~6 min的平均反应速率:v(H2O2)≈3.3×10-2 mol/(L·min)
B. 6~10 min的平均反应速率:v(H2O2)<3.3×10-2 mol/(L·min)
C. 反应至6 min时,c(H2O2)=0.3 mol/L
D. 反应至6 min时,H2O2分解了50%