题目内容
(1) ①B(2分) ②Na2CO3(1分);相同浓度的Na2CO3和NaHCO3溶液中,前者c(CO32-)较大 (1分)
(2)蒸发浓缩(1分)、冷却结晶(1分) 取少量晶体溶于蒸馏水,然后用盐酸酸化,再滴BaCl2溶液,若出现白色沉淀,即证明该晶体中含有SO42- (2分)
(3)HNO3(1分)浸出时部分铅离子生成PbSO4随浸出渣排出,降低PbSO4的产率(2分)
(4)4 PbSO4 + 6OH- ="3" PbO·PbSO4·H2O + 3 SO42- + 2 H2O (2分)
(5) 60(2分)
解析试题分析:(1) ①对于PbSO4(s)+CO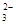 (aq)
(aq) PbCO3(s)+SO42-(aq)可知:
PbCO3(s)+SO42-(aq)可知:
反应的平衡常数
根据转化关系可知PbSO4的Ksp比PbCO3的Ksp大,A正确;当K=1,平衡时才有c(CO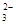 )=c(SO42-),B不正确;C正确。
)=c(SO42-),B不正确;C正确。
②室温时,向两份相同的PbSO4样品中分别加入同体积、同浓度的Na2CO3和NaHCO3溶液均可实现上述转化,前者c(CO32-)较大, PbSO4转化率较大。
(2)滤液A能用来回收Na2SO4·10H2O,提取该晶体的主要步骤有干燥蒸发浓缩、冷却结晶、过滤、洗涤;检验该晶体中SO42-的实验方法是取少量晶体溶于蒸馏水,然后用盐酸酸化,再滴BaCl2溶液,若出现白色沉淀,即证明该晶体中含有SO42-。
(3)可循环使用的物质HNO3;若HNO3中残留的SO42-过多,循环利用时可能出现的问题是浸出时部分铅离子生成PbSO4随浸出渣排出,降低PbSO4的产率;
(5)由于:Na2SO3+PbO2===PbO+ Na2SO4可知:n(Na2SO3)=n(PbO2)= =0.03mol,故需要加入60mL的0.5 mol·L-1 Na2SO3溶液。
=0.03mol,故需要加入60mL的0.5 mol·L-1 Na2SO3溶液。
考点:化学工业中的条件选择、分离操作、离子检验及相关反应原理。

 暑假作业暑假快乐练西安出版社系列答案
暑假作业暑假快乐练西安出版社系列答案 新活力总动员暑系列答案
新活力总动员暑系列答案 龙人图书快乐假期暑假作业郑州大学出版社系列答案
龙人图书快乐假期暑假作业郑州大学出版社系列答案铁及其化合物在日常生活、生产中应用广泛.研究铁及其化合物的应用意义重大.
I.水体的净化和污水的处理与铁及其化合物密切相关.
(1)自来水厂常用高铁酸钠(Na2FeO4)改善水质.简述高铁酸钠用于杀菌消毒同时又起到净水作用的原理 .
(2)碱式硫酸铁[Fe(OH)SO4]是一种用于污水处理的新型高效絮凝剂,在医药上也可用于治疗消化性溃疡出血.工业上利用废铁屑(含少量氧化铝、氧化铁等)生产碱式硫酸铁的工艺流程如下:
已知:部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 |
| 开始沉淀 | 2.3 | 7.5 | 3.4 |
| 完全沉淀 | 3.2 | 9.7 | 4.4 |
回答下列问题:
①写出反应I中主要发生的氧化还原反应的离子方程式 .
②加入少量NaHCO3的目的是调节溶液pH,应控制pH的范围为 .
③在实际生产中,反应II常同时通入O2以减少NaNO2的用量,若通入5.6L O2(标准状况),则相当于节约NaNO2的质量为 g.
④碱式硫酸铁溶于水后产生的[Fe(OH)]2+离子,可部分水解生成[Fe2(OH)4]2+聚合离子.该水解反应的离子方程式为 .
II铁的化合物也是制备高能锂电池的重要原料.已知磷酸亚铁锂电池总反应为:FePO4+Li
 LiFePO4,电池中的固体电解质可传导Li+.试写出该电池充电时的阳极反应式 .
LiFePO4,电池中的固体电解质可传导Li+.试写出该电池充电时的阳极反应式 . 碘酸钾(KIO3)晶体是我国规定的食盐加碘剂。它通常是以碘为原料与过量KOH溶液通过下列反应制得:3I2+6KOH=5KI+KIO3+3H2O,再将KI和KIO3的混合溶液电解,将其中的I―转化为IO3―,装置如图。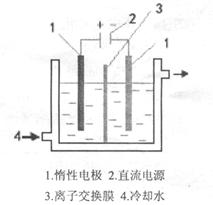
(1)在反应3I2+6KOH=5KI+KIO3+3H2O中,氧化剂和还原剂的物质的量之比为 。
(2)电解前,将KI和KIO3混合溶液加入阳极区;将氢氧化钾溶液加入阴极区。电解槽用水冷却。电解时,阳极上的电极反应 ;阴极上得到的气体产物为 ;
(3)某同学查资料获知:KIO3在酸性介质中与碘化物作用生成单质碘,该反应的离子反应方程式为 ,为确定电解是否完成,需检验阳极区电解液中是否含有I―,该同学选用淀粉溶液和稀硫酸进行实验,其它仪器及用品自选,请完成其方案:
| 实验操作 | 现象及结论 |
| | |
(4)电解完毕,从电解液中得到KIO3晶体的过程为:
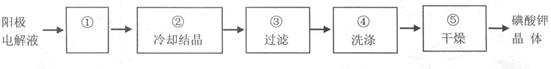
步骤①的操作名称 ,步骤④中洗涤晶体的目的 。
.某有机物的结构简式为CH3—CH2—CH=CH—CHO,下列关于该有机物的说法不正确的是
| A.该有机物可与新制Cu(OH)2悬浊液反应 |
| B.该有机物不能发生水解反应 |
| C.该有机物的核磁共振氢谱图有5个波峰 |
| D.该有机物不能使溴水褪色 |






 CuCl42-(黄色)+4H2O;电解不同浓度的CuCl2溶液,均可看做Cu2+、Cl-直接放电。下图为电解浓度较大CuCl2溶液的装置,实验开始后,观察到丙中的KI-淀粉溶液慢慢变蓝。回答下列问题:
CuCl42-(黄色)+4H2O;电解不同浓度的CuCl2溶液,均可看做Cu2+、Cl-直接放电。下图为电解浓度较大CuCl2溶液的装置,实验开始后,观察到丙中的KI-淀粉溶液慢慢变蓝。回答下列问题: