题目内容
下列各组离子,能在溶液中大量共存的是
- A.Na+、Fe3+、AlO2-、Br-
- B.H+、Fe2+、SO42-、NO3-
- C.K+、NH4+、CO32-、OH-
- D.Ca2+、Al3+、NO3-、Cl-
D
离子间如果发生化学反应,则不能大量共存,反之可以大量共存。A中Fe3+和AlO2-水解相互促进生成氢氧化铁和氢氧化铝沉淀。B中H+、Fe2+和NO3-发生氧化还原反应,生成铁离子和NO。C中NH4+和OH-发生复分解反应生成氨水,所以只有选项D是正确的,答案选D。
离子间如果发生化学反应,则不能大量共存,反之可以大量共存。A中Fe3+和AlO2-水解相互促进生成氢氧化铁和氢氧化铝沉淀。B中H+、Fe2+和NO3-发生氧化还原反应,生成铁离子和NO。C中NH4+和OH-发生复分解反应生成氨水,所以只有选项D是正确的,答案选D。

练习册系列答案
 暑假作业暑假快乐练西安出版社系列答案
暑假作业暑假快乐练西安出版社系列答案
相关题目
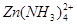 。
。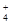 ,Na+,HSO
,Na+,HSO ,PO
,PO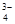 ,MnO
,MnO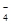
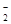 ,NO
,NO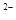 ,SO
,SO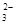
 ,CO
,CO ,Cl
,Cl =0.1 mol/L的溶液中:Na+,K+,SO
=0.1 mol/L的溶液中:Na+,K+,SO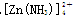 。
。