题目内容
锌和铝都是活泼金属,其氢氧化物既能溶于强酸,又能溶于强碱。但是氢氧化铝不溶于氨水,而氢氧化锌能溶于氨水,生成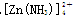 。
。
回答下列问题:
(1)单质铝溶于氢氧化钠溶液后,溶液中铝元素的存在形式为________(用化学式表示)。
(2)写出锌和氢氧化钠溶液反应的化学方程式
________________________________________________________________________。
(3)下列各组中的两种溶液,用相互滴加的实验方法即可鉴别的是________。
①硫酸铝和氢氧化钠 ②硫酸铝和氨水 ③硫酸锌和氢氧化钠 ④硫酸锌和氨水
(4)写出可溶性铝盐与氨水反应的离子方程式
________________________________________________________________________。
试解释在实验室不适宜用可溶性锌盐与氨水反应制备Zn(OH)2的原因
________________________________________________________________________。
:(1)AlO2- (2)Zn+2NaOH===Na2ZnO2+H2↑ (3)①③④
(4)Al3++3NH3·H2O===Al(OH)3↓+3 NH4+ 可溶性锌盐与氨水反应产生的Zn(OH)2可溶于过量的氨水中,生成[Zn(NH3)4]2+,氨水用量不易控制
【解析】
试题分析:(1)Al与NaOH反应的化学方程式为2Al+2NaOH+2H2O===2NaAlO2+3H2↑。溶液中铝元素以AlO2-形式存在。
(2)Zn与NaOH反应的化学方程式为Zn+2NaOH===Na2ZnO2+H2↑。
(3)①Al2(SO4)3滴入NaOH溶液中无沉淀,产物是AlO2-;NaOH溶液滴入Al2(SO4)3溶液中有沉淀。
②Al2(SO4)3溶液滴入氨水中有沉淀;氨水滴入Al2(SO4)3溶液中有沉淀,发生了同样的反应:Al3++3NH3·H2O===Al(OH)3↓+3NH4+。
③ZnSO4溶液滴入NaOH溶液中无沉淀:Zn2++4OH-===ZnO+2H2O;NaOH溶液滴入ZnSO4溶液中有沉淀;Zn2++2OH-===Zn(OH)2↓。
④ZnSO4溶液滴入氨水中无沉淀:Zn2++4NH3===[Zn(NH3)4]2+;氨水滴入ZnSO4溶液中有沉淀:Zn2++2NH3·H2O===Zn(OH)2↓+2NH4+。所以用互滴的实验方法就能鉴别①③④。
(4)可溶性锌盐与氨水的反应由④可以看出,一旦氨水过量就会有部分Zn(OH)2溶解:Zn(OH)2+4NH3===[Zn(NH3)4]2++2OH-,即在实验过程中加入氨水的用量不易控制。
考点:考查金属铝和锌的性质、物质的鉴别以及氢氧化锌的制备
点评:该题是高考中的常见题型,属于中等难度的试题。试题综合性强,在注重对学生基础知识巩固和训练的同时,侧重对学生解题能力的培养和训练,有利于培养学生的逻辑推理能力和发散思维能力,提高学生灵活运用基础知识解决实际问题的能力,同时也有助于培养学生的自学能力和知识的迁移能力。

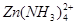 。
。 。回答下列问题:
。回答下列问题: