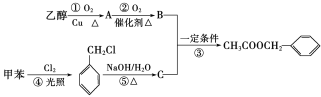
题目内容
【题目】将0.4gNaOH和1.06gNa2CO3混合并配成溶液,向溶液中滴加0.1mol·L--1稀盐酸。下列图像能正确表示加入盐酸的体积和生成CO2的物质的量的关系是( )
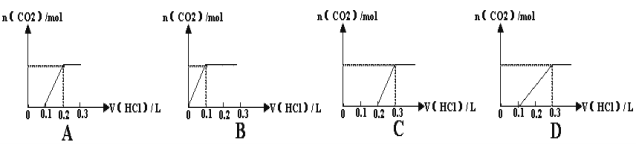
【答案】C
【解析】
试题分析:对NaOH和Na2CO3混合配成的溶液,当滴加盐酸时,先发生NaOH+HCl=NaCl+H2O,再发生Na2CO3+HCl=NaCl+NaHCO3,最后发生NaHCO3+HCl=NaCl+CO2↑+H2O,此时才有二氧化碳气体生成。A、0.1mol盐酸与氢氧化钠反应没有气体生成,但碳酸钠与盐酸反应生成碳酸氢钠时也没有气体生成,则图象与反应不符,故A错误;B、图象中开始反应即有气体生成,与反应不符,故B错误;C、向NaOH和Na2CO3混合溶液中滴加盐酸时,首先和NaOH反应生成水和氯化钠,当滴入0.1L时,两者恰好反应完全;继续滴加时,盐酸和Na2CO3开始反应,首先发生HCl+Na2CO3=NaHCO3+NaCl,不放出气体,当再加入0.1L时,此步反应进行完全;继续滴加时,发生反应:NaHCO3+HCl=NaCl+H2O+CO2↑;此时开始放出气体,正好与图象相符,故C正确;D、因碳酸钠与盐酸的反应分步完成,则碳酸钠与盐酸先反应生成碳酸氢钠和氯化钠,此时没有气体生成,则图象与反应不符,故D错误;故选C。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】X、Y、Z、W代表短周期的四种元素,有关它们的部分信息如下表所示:
元素 | 部分结构特点 | 部分性质 |
X | X的单质由双原子分子构成,分子中有14个电子 | X有多种氧化物,如XO、XO2等 |
Y | Y原子的次外层电子数等于最外层电子数的一半 | Y元素能形成多种单质 |
Z | Z原子的最外层电子数多于4 | Z元素的最高正化合价与最低负化合价的代数和等于6 |
W | 第三周期元素的简单离子中半径最小 | W的单质化学性质虽较活泼,但只需常温保存 |
请按要求回答下列问题(注意不能用字母X、Y、Z、W作答,请用相应的元素符号或化学式填写):
(1)X的元素名称是 ,X的气态氢化物的电子式是 。
(2)Z元素在周期表中的位置是第 周期,第 族。Z和W形成的化合物属于 化合物(填“离子”或“共价”)。
(3)X、Y、Z、W的原子半径从大到小的顺序是 。
(4)X、Y、Z三种元素的最高价氧化物的水化物的酸性由强到弱的顺序是: 。
(5)铜和X的最高价氧化物的水化物的浓溶液反应的化学方程式: 。
(6)气体分子(YX)2称为拟卤素,性质与卤素类似,请写出(YX)2与NaOH溶液反应的化学方程式: 。