题目内容
【题目】(一)请认真观察下图,然后回答问题。
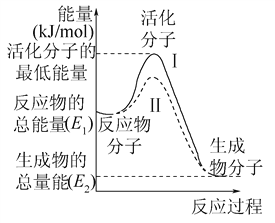
图中所示反应是__________(填“吸热”或“放热”)反应,该反应的ΔH=__________(用含E1、E2的代数式表示)。
(二)已知下列热化学方程式:
①H2(g)+![]() O2(g)===H2O(l) ΔH=-285.8 kJ/mol
O2(g)===H2O(l) ΔH=-285.8 kJ/mol
②H2(g)+![]() O2(g)===H2O(g) ΔH=-241.8 kJ/mol
O2(g)===H2O(g) ΔH=-241.8 kJ/mol
③C(s)+![]() O2(g)===CO(g) ΔH=-110.5 kJ/mol
O2(g)===CO(g) ΔH=-110.5 kJ/mol
④C(s)+O2(g)===CO2(g) ΔH=-393.5 kJ/mol
回答下列各问题:
(1)H2的燃烧热为__________;C的燃烧热为________。
(2)上述反应中属于放热反应的是__________________。(填序号)
【答案】 放热 E2-E1 285.8 kJ/mol 393.5 kJ/mol ①②③④
【解析】一、(1)图示反应是放热反应,反应物断键要吸收能量,所以该反应需要环境先提供能量,反应热等于生成物与反应物的能量差,即E1-E2;
二、(1)燃烧热是指1mol可燃物在氧气中完全燃烧生成稳定氧化物所释放的能量,则上述反应中H2的燃烧热为285.8 kJ/mol,C的燃烧热为393.5 kJ/mol;
(2)上述反应均为放热反应,即①②③④是放热反应。

练习册系列答案
相关题目