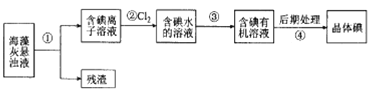
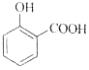
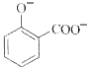
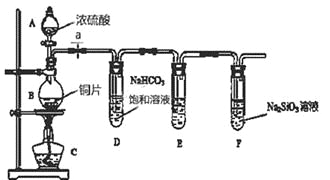
题目内容
【题目】X、Y、W、Z是四种常见的短周期元素,其原子半径随原子序数表化如下图所示。已知X的一种核素的质量数为18,中子数为10,Y和Ne原子的核外电子总数相差1;W的单质是一种常见的半导体材料;Z的非金属性在同周期主族元素中最强。

(1)W位于元素周期表中第 周期第 族。画出X的阴离子的结构示意图 。
(2)Z的氢化物和溴化氢相比,较稳定的是 (写化学式);Z的氢化物与氟化氢相比,沸点较高的是 (写化学式)。
(3)Y的金属性与Mg的金属性相比, (写化学式)的金属性强,请用实验证明它们金属性的相对强弱: 。
(4)写出Y的最高价氧化物对应的水化物与Z的最高价氧化物对应的水化物发生反应的化学反应方程式: 。
【答案】(1)三、IVA(各1分)离子结构示意图略(1分)
(2)HCl(1分);HF(1分);
(3)Na(1分)Na与冷水剧烈反应,而Mg与冷水反应较慢(其它合理答案也可)(2分)
(4)NaOH+HClO4=NaClO4+H2O(2分)
【解析】
试题分析: X、Y、W、Z是四种常见的短周期元素,已知X的一种核素的质量数为18,中子数为10,则X元素原子的质子数为18-10=8,故X为氧元素;Y和Ne原子的核外电子数相差1,X为Na或F,X原子半径大于氧原子,故X为Na元素;W的单质是一种常见的半导体材料,原子序数大于Na元素,故W为Si元素;Z的吸引电子的能力在同周期主族元素中最大,原子序数大于Si,故Z为Cl元素。(1)W为Si,原子核外电子数为14,有3个电子层,最外层电子数为4,处于周期表中第三周期IVA族;(2)Z为Cl元素,由于元素的非金属性Cl>Br,故氢化物稳定性HCl>HBr,较稳定的是HCl;由于在HF分子之间存在氢键,增加了分子之间的吸引力,所以物质的熔沸点较高的是HF;(3)同周期随原子序数增大原子半径减小,原子失去电子的能力逐渐减弱,元素的金属性逐渐减弱,所以金属性Na>Mg;元素的金属性越强,其单质与水货酸置换出氢气就越容易。所以可以通过Na与冷水剧烈反应,而Mg与冷水反应较慢证明元素的金属性Na>Mg;(4)Y的最高价氧化物对应的水化物NaOH是强碱,Z的最高价氧化物对应的水化物HClO4是一元强酸,二者发生酸碱中和反应,产生高氯酸钠和水,发生反应的化学反应方程式是NaOH+HClO4=NaClO4+H2O。

【题目】
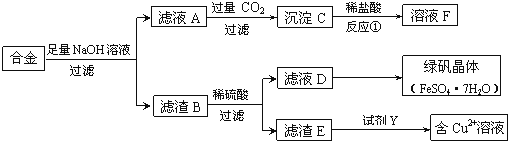
(1)合金与足量氢氧化钠溶液反应的离子方程式是 。
(2)若D中含有Fe3+,除去Fe3+的常用试剂是 。
(3)若要从滤液D中得到绿矾晶体,必须进行的实验操作步骤: 、冷却结晶、过滤、自然干燥。
(4)若由滤渣E得到含Cu2+的溶液,试剂Y可能是 (填选项字母)。
A.稀硝酸 | B.浓硫酸 | C.浓盐酸 | D.稀硫酸 |
根据所选试剂写出一个由滤渣E得到含Cu2+溶液的化学方程式: 。