题目内容
硫酸铅广泛应用于制造蓄电池。利用锌冶炼过程中的铅浮渣生产硫酸铅的流程如下: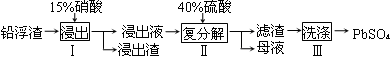
已知铅浮渣的主要成分是PbO、Pb,还含有少量Ag、Zn、CaO和其他不溶于硝酸的杂质。25℃时,Ksp(CaSO4)=4.9×10-5,Ksp(PbSO4)=1.6×10-8。
(1)已知步骤Ⅰ有NO产生,浸出液中含量最多的阳离子是Pb2+。分别写出PbO、Pb参加反应的离子方程式 、 。
(2)步骤Ⅰ需控制硝酸的用量并使Pb稍有剩余,目的是 。
(3)母液可循环利用于步骤Ⅰ,其溶质主要是 (填一种物质化学式),若母液中残留的SO42-过多,循环利用时可能出现的问题是 。
(4)产品PbSO4还需用Pb(NO3)2溶液多次洗涤,目的是除去 。
(5)铅蓄电池的电解液是硫酸,充电后两个电极上沉积的PbSO4分别转化为PbO2和Pb,充电时阴极的电极反应式为 。
(1)PbO+2H+=Pb2++H2O (2分);
3Pb+8H++2NO3-=3Pb2++2NO↑+4H2O (2分)
(2)防止Ag被溶解进入溶液(或使Ag留在浸出渣中)(2分)
(3)HNO3(2分);浸出时部分铅离子生成PbSO4随浸出渣排出,降低PbSO4的产率(2分)
(4)CaSO4杂质(2分)
(5)PbSO4+2e-=Pb+SO42- (3分)
解析试题分析:(1)PbO与硝酸发生非氧化还原反应,离子方程式为PbO+2H+=Pb2++H2O;Pb与硝酸发生氧化还原反应,有NO气体放出,离子方程式为3Pb+8H++2NO3-=3Pb2++2NO↑+4H2O ;
(2)Pb的活泼性比Ag强,Ag也可与硝酸反应,所以使Pb稍有剩余目的是防止Ag被溶解进入溶液(或使Ag留在浸出渣中);
(3)硫酸铅不溶于硝酸,所以硝酸铅与硫酸发生复分解反应,生成硫酸铅和硝酸,因此母液的主要溶质是HNO3;若母液中残留的SO42-过多,则在步骤Ⅰ中就有硫酸铅沉淀生成,随浸出渣排出,降低PbSO4的产率;
(4)浸出液中除含硝酸铅外还有硝酸钙,与硫酸反应有微溶的硫酸钙生成,所以洗涤的目的是除去CaSO4杂质;
(5)充电时铅蓄电池相当于电解池,阴极是硫酸铅发生还原反应生成Pb单质,电极反应式为PbSO4+2e-=Pb+SO42- 。
考点:考查硫酸铅的制取,离子方程式、电极反应式的书写,对实验步骤的分析判断

下列除去杂质的方法正确的是
①除去乙烷中少量的乙烯:一定条件下通入H2
②除去乙酸乙酯中少量的乙酸:用饱和碳酸钠溶液洗涤,分液、干燥、蒸馏
③获得无水乙醇的方法通常是先用浓H2SO4吸水,然后再加热蒸馏
④除去乙醇中少量的水:加足量新制生石灰,蒸馏
| A.①② | B.②③ |
| C.③④ | D.②④ |
为回收利用废钒催化剂(含有V2O5、VOSO4及不溶性残渣),科研人员最新研制了一种离子交换法回收钒的新工艺,主要流程如下: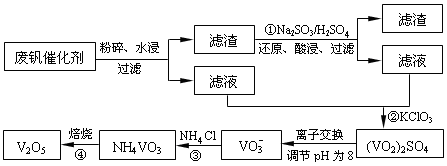
部分含钒物质在水中的溶解性如下:
| 物质 | VOSO4 | V2O5 | NH4VO3 | (VO2)2SO4 |
| 溶解性 | 可溶 | 难溶 | 难溶 | 易溶 |
回答下列问题:
(1)工业由V2O5冶炼金属钒常用铝热剂法,该反应的氧化剂为_____________。
(2)滤液中含钒的主要成分为______________(填化学式)。
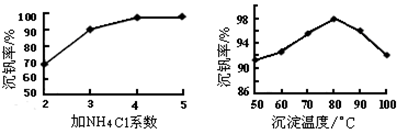
(3)该工艺中反应③的沉淀率(又称沉钒率)是回收钒的关键之一,该步反应的离子方程式____;沉钒率的高低除受溶液pH影响外,还需要控制氯化铵系数(NH4Cl加入质量与料液中V2O5的质量比)和温度。根据下图判断最佳控制氯化铵系数和温度为___________、_________℃。
(4)用硫酸酸化的H2C2O4溶液滴定(VO2)2SO4溶液,以测定反应②后溶液中含钒量,反应方程式为:2VO2++H2C2O4+2H+=2VOn+ + 2CO2↑+ mH2O,其中n、m分别为______________、________ 。
(5)全钒液流电池的电解质溶液为VOSO4溶液,电池的工作原理为:

电池放电时正极的电极反应式为 。
工业上利用电镀污泥(主要含有Fe2O3、CuO、Cr2O3及部分难溶杂质)回收铜和铬等金属,回收流程如下: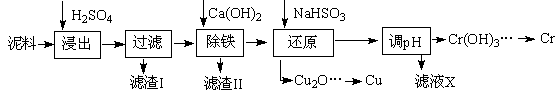
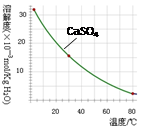
已知部分物质沉淀的pH及CaSO4的溶解度曲线如下:
| | Fe3+ | Cu2+ | Cr3+ |
| 开始沉淀pH | 2.1 | 4.7 | 4.3 |
| 完全沉淀pH | 3.2 | 6.7 | a |
(1)在浸出过程中除了生成Fe2(SO4)3、Cr2(SO4)3外,主要还有
(2)在除铁操作中,需要除去Fe3+和CaSO4,请完成相关操作:①加入石灰乳调节pH到 ;②将浊液加热到80℃, 。
(3)写出还原步骤中加入NaHSO3生成Cu2O固体的离子反应方程式 ,此步骤中加入NaHSO3得到Cu2O的产率为95%,若NaHSO3过量,除了浪费试剂外,还会出现的问题是 。
(4)当离子浓度≤1×10—5 mol?L-1认为沉淀完全,若要使Cr3+完全沉淀则要保持C(OH—)≥ 。已知:Ksp[Cr(OH)3]=6.3×10-31,
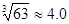 )
) 

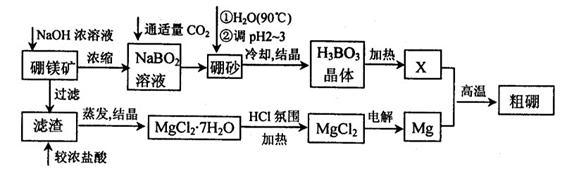
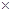 10-12,当溶液pH=6时 (填“有”或“没有”)Mg(OH)2沉淀析出。
10-12,当溶液pH=6时 (填“有”或“没有”)Mg(OH)2沉淀析出。
