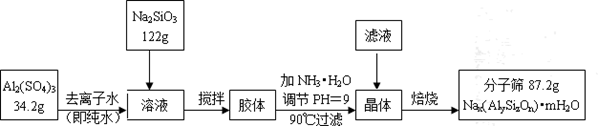
题目内容
为回收利用废钒催化剂(含有V2O5、VOSO4及不溶性残渣),科研人员最新研制了一种离子交换法回收钒的新工艺,主要流程如下: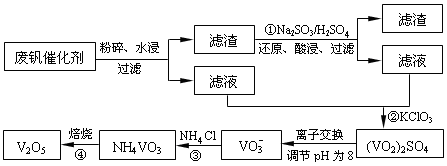
部分含钒物质在水中的溶解性如下:
| 物质 | VOSO4 | V2O5 | NH4VO3 | (VO2)2SO4 |
| 溶解性 | 可溶 | 难溶 | 难溶 | 易溶 |
回答下列问题:
(1)工业由V2O5冶炼金属钒常用铝热剂法,该反应的氧化剂为_____________。
(2)滤液中含钒的主要成分为______________(填化学式)。
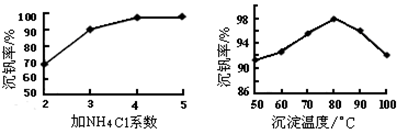
(3)该工艺中反应③的沉淀率(又称沉钒率)是回收钒的关键之一,该步反应的离子方程式____;沉钒率的高低除受溶液pH影响外,还需要控制氯化铵系数(NH4Cl加入质量与料液中V2O5的质量比)和温度。根据下图判断最佳控制氯化铵系数和温度为___________、_________℃。
(4)用硫酸酸化的H2C2O4溶液滴定(VO2)2SO4溶液,以测定反应②后溶液中含钒量,反应方程式为:2VO2++H2C2O4+2H+=2VOn+ + 2CO2↑+ mH2O,其中n、m分别为______________、________ 。
(5)全钒液流电池的电解质溶液为VOSO4溶液,电池的工作原理为:

电池放电时正极的电极反应式为 。
(15分)(1)V2O5(1分)(2)VOSO4(2分)(3)NH4++VO3- =NH4VO3↓(2分);
4(2分);80(2分) (4)2(2分);2(2分) (5)VO2++ 2H++e-= VO2++H2O(2分)
解析试题分析:(1)铝和五氧化二钒发生铝热反应的方程式为:3V2O5+10Al 6V+5Al2O3,反应中氧化剂是V2O5;
6V+5Al2O3,反应中氧化剂是V2O5;
(2)根据溶解性表知,V2O5难溶,VOSO4可溶,因此滤渣是V2O5,滤液中含矾的主要成分的化学式为VOSO4;
(3)根据NH4VO3难溶可知,反应③是复分解反应,方程式为NH4++VO3- =NH4VO3↓;根据图像可知氯化铵系数为4、温度为80℃时沉淀率最高,所以最佳控制氯化铵系数和温度为4和80℃。
(4)根据方程式2VO2++H2C2O4+2H+=2VOn+ + 2CO2↑+ mH2O可知草酸中碳元素的化合价从+3价升高到+4价,失去1个电子,1mol草酸失去2mol电子,则根据电子得失守恒可知氧化剂得到2mol电子,所以1mol VO2+得到1mol电子,V元素的化合价从+5价降低+4价,因此n=2;根据氢原子守恒可知m=2。
(5)放电是原电池,正极得到电子,则根据总反应式可知,放电时VO2+得到电子,电极反应式为 VO2++ 2H++e-=VO2++H2O。
考点:考查氧化还原反应的有关应用与计算、反应条件的选择以及电化学原理的应用

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
从海带中提取碘的实验过程中,涉及到下列操作,其中正确的是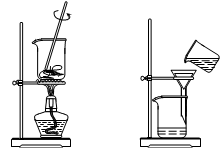
| A.将海带灼烧 | B.过滤含I-溶液 | C.放出碘的苯溶液 | D.分离碘并回收苯 |
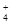 、SO
、SO 离子的实验方法正确的是________(填编号)。
离子的实验方法正确的是________(填编号)。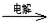 MnO2+Zn+2H2SO4。
MnO2+Zn+2H2SO4。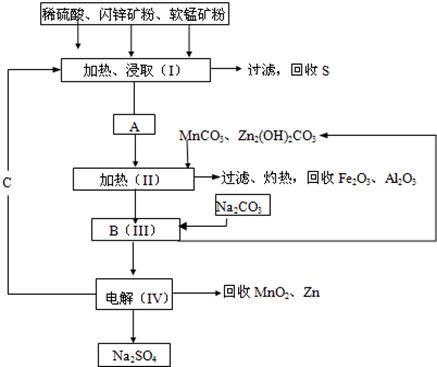
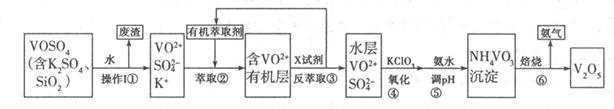
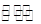 2RAn(有机层)+nH2SO4(水层),
2RAn(有机层)+nH2SO4(水层),