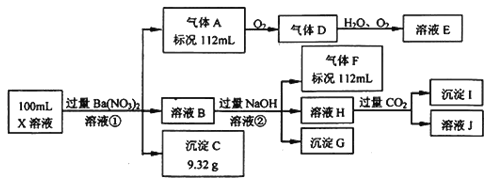
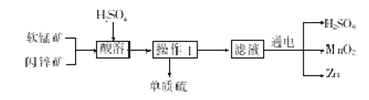
题目内容
【题目】分A、B、C、D、E五种短周期元素,它们的原子序数依次增大;A元素是所有原子中半径最小的原子;B元素的最高价氧化物对应水化物与其氢化物生成一种盐X;D与A同主族,且与E同周期;E元素的最外层电子数是其次外层电子数的3/4,A、B、D、E这四种元素中,每一种都与C元素形成原子个数比不相同的化合物。
请回答下列问题:
(1)D位于元素周期表第 周期 族。
(2)C和E两元素相比较,非金属性较强的是__________(填元素名称),可以验证该结论的是_________________(填写编号);
A.比较这两种元素的气态氢化物的沸点
B.比较这两种元素的单质在常温下的状态
C.比较这两种元素气态氢化物的稳定性
D.比较这两种元素单质与氢气化合的难易
(3)写出C、D两元素形成的原子个数比为1:1的化合物与水反应的离子方程式: 。
(4)A与C间可形成负一价双原子阴离子,有10个电子,写出该阴离子与盐酸反应的离子方程式为 ;
(5)A、C 、D、E四种元素可形成两种酸式盐,两种酸式盐相互反应的离子方程式为 .
【答案】(1)第3周期ⅠA族;
(2)氧;CD;
(3)2Na2O2+ 2H2O =" 4NaOH" + O2↑;
(4)H++OH-=H2O;
(5)HSO3-+H+═SO2↑+H2O。
【解析】试题分析:A、B、C、D、E五种短周期元素,它们的原子序数依次增大,A元素的原子半径最小,则A为H;B元素的最高价氧化物对应水化物与其氢化物能生成盐,则B为N;E元素原子的最外层电子数是其次外层电子数的![]() ,则E为S;D与A同主族,且与E同周期,则D为Na;A、B、D、E这四种元素,每一种与C元素都能形成元素的原子个数比不相同的多种化合物,则C为O。
,则E为S;D与A同主族,且与E同周期,则D为Na;A、B、D、E这四种元素,每一种与C元素都能形成元素的原子个数比不相同的多种化合物,则C为O。
(1)D为Na,位于元素周期表第3周期ⅠA族,故答案为:第3周期ⅠA族;
(2)氧与硫同主族,从上到下非金属性在减弱,则非金属性O>S,可以利用与氢气化合的难易程度及气态氢化物的稳定性、单质的氧化性等来判断,氢化物沸点、单质的状态都属于物理性质,不能比较非金属性强弱,故AB错误、CD正确,故答案为:氧;CD;
(3)C、D两元素形成的原子个数比为1:1的化合物为Na2O2,与水反应的化学方程式为2Na2O2+ 2H2O =" 4NaOH" + O2↑,故答案为:2Na2O2+ 2H2O =" 4NaOH" + O2↑;
(4)A与C间可形成负一价双原子阴离子,有10个电子,为OH-,该阴离子与盐酸反应的离子方程式为H++OH-=H2O,故答案为:H++OH-=H2O;
(5)A、C、D、E可形成两种酸式盐为NaHSO3和NaHSO4,离子反应为HSO3-+H+═SO2↑+H2O,故答案为:HSO3-+H+═SO2↑+H2O。

 轻松课堂单元测试AB卷系列答案
轻松课堂单元测试AB卷系列答案 小题狂做系列答案
小题狂做系列答案