题目内容
用NA表示阿伏加德罗常数的值,下列说法不正确的是
| A.12.0g熔融的NaHSO4中含有的阳离子数为0.1NA |
| B.常温下,5.6gFe投入到足量浓硝酸中,转移电子数为0.3 NA |
| C.2 mol SO2和1 mol O2在一定条件下充分反应后,所得混合气体的分子数大于2 NA |
| D.足量的锌与一定量的浓硫酸反应生成1 mol气体时,转移的电子数为2NA |
B
解析试题分析:A、12.0g NaHSO4的物质的量为:12.0g÷120g/mol=0.1mol,熔融的NaHSO4电离生成Na+和HSO4?,所以12.0g熔融的NaHSO4中含有的阳离子数为0.1NA,正确;B、Fe与浓硝酸反应可能生成Fe(NO3)3,也可能生成Fe(NO3)2或Fe(NO3)3与Fe(NO3)2的混合物,若生成Fe(NO3)3转移电子数为0.3 NA,若生成Fe(NO3)2转移电子数为0.2 NA,所以转移电子数为0.2 NA~ 0.3NA,错误;C、SO2与O2反应为可逆反应,所以2 mol SO2和1 mol O2在一定条件下充分反应后,所得混合气体的分子数大于2 NA,正确;D、足量的锌与一定量的浓硫酸反应,开始生成SO2,Zn+2H2SO4(浓)=ZnSO4+SO2↑+2H2O,随着反应的进行,硫酸的浓度变稀,生成H2,气体与转移电子的物质的量之比都是1:2,所以生成1 mol气体时,转移的电子数为2NA,正确。
考点:本题考查阿伏伽德罗常数的综合应用。

练习册系列答案
 寒假创新型自主学习第三学期寒假衔接系列答案
寒假创新型自主学习第三学期寒假衔接系列答案
相关题目
0.8 g某物质含有3.01×1022个分子,该物质的相对分子质量约为
| A.8 | B.16 | C.64 | D.160 |
NA表示阿伏伽德罗常数,下列说法正确的是
| A.在常温常压下,14 g N2含有的分子数为0.5NA |
| B.25℃、101.3kPa时,11.2L H2中含有的原子数为NA |
| C.标准状况下,1mol CCl4的体积约为22.4 L |
| D.2.3g的金属钠变为钠离子时失去的电子数为0.2NA |
用NA表示阿伏加德罗常数的值,下列叙述正确的是
| A.1molCl2与足量Fe反应,转移的电子数为3NA |
| B.在常温常压下,1.7g NH3含有的原子数为0.4NA |
| C.标准状况下,11.2 L水中含有的原子数是1.5NA |
| D.0.2mol?L-1的 Na2SO4溶液中含Na+数目为0.4NA |
下列化学用语表示正确的是 ( )。
A.Cl-的结构示意图: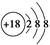 |
B.甲烷分子的球棍模型: |
C.氢氧化钠的电子式: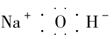 |
| D.次氯酸的结构式:H—O—Cl |
下列关于物质的量的叙述中,正确的是( )。
| A.1 mol任何物质都含有6.02×1023个分子 |
| B.0.012 kg12C中含有约6.02×1023个碳分子 |
| C.1 mol水中含有2 mol氢和1 mol氧 |
| D.1 mol Ne中含有6.02×1024个电子 |
下图是NaCl、MgSO4的溶解度曲线。下列说法正确的是( )。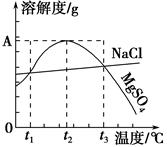
| A.只有在t1℃时,NaCl和MgSO4的溶解度才相等 |
| B.t1℃~t2℃,MgSO4的溶解度随温度升高而减小 |
| C.在t2℃时,MgSO4饱和溶液的溶质质量分数最大 |
| D.把MgSO4饱和溶液的温度从t3℃降至t2℃时,溶液的物质的量浓度减小 |
设NA代表阿伏加德罗常数的数值。已知C2H4和C3H6的混合物的质量为a g,则该混合物( )
| A.所含共用电子对数目为(+1)NA |
| B.所含碳氢键数目为NA |
C.燃烧时消耗的O2一定是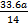 L L |
D.所含原子总数为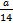 NA NA |
 KI+3I2+3H2O中,每生成3 mol I2转移的电子数为6NA
KI+3I2+3H2O中,每生成3 mol I2转移的电子数为6NA