题目内容
0.8 g某物质含有3.01×1022个分子,该物质的相对分子质量约为
| A.8 | B.16 | C.64 | D.160 |
B
解析试题分析:根据n=N/NA计算0.8g该物质的物质的量为0.05mol,再根据M=m/n计算该物质的摩尔质量为16g/mol,进而确定该物质的相对分子质量为16,选B。
考点:考查常用化学计量的有关计算、相对分子质量的计算。

练习册系列答案
相关题目
用NA表示阿伏加德罗常数的值,下列说法不正确的是
| A.12.0g熔融的NaHSO4中含有的阳离子数为0.1NA |
| B.常温下,5.6gFe投入到足量浓硝酸中,转移电子数为0.3 NA |
| C.2 mol SO2和1 mol O2在一定条件下充分反应后,所得混合气体的分子数大于2 NA |
| D.足量的锌与一定量的浓硫酸反应生成1 mol气体时,转移的电子数为2NA |
下列数值最接近阿伏伽德罗常数的是
| A.标准状况下22.4L乙醇中的分子数 | B.48g臭氧中的原子数 |
| C.常温常压下6mL水的原子数 | D.1 L l mol/L氨水中的离子数 |
CaCl2溶解在1mol H2O中,使Cl—与H2O分子的物质的量之比为1:10时,CaCl2为( )
| A.0.1mol | B.10mol | C.0.5mol | D.0.05mol |
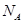 表示阿伏加德罗常数,下列说法中正确的是
表示阿伏加德罗常数,下列说法中正确的是
A.2.4g镁与足量的盐酸反应,电子转移数目为0.1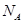 |
B.0.5mol/L的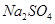 的溶液中含 的溶液中含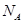 个 个 |
C.1mol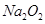 固体中含2 固体中含2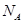 个阴离子 个阴离子 |
D.1mol 离子所含电子数为10 离子所含电子数为10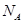 |
将4gNaOH溶解在10mL水中,然后稀释成1L溶液,从中取出10mL,这10mL溶液的物质的量浓度是( )
| A.1mol·L-1 | B.0.1 mol·L-1 | C.0.01 mol·L-1 | D.10 mol·L-1 |
在100 mL HNO3和H2SO4的混合溶液中,加入100 mL 0.2 mol/L Ba(OH)2溶液后,pH变为7,同时生成2.33 g白色沉淀,则原混合溶液中HNO3的物质的量浓度为( )
| A.0.1 mol/L | B.0.2 mol/L |
| C.0.3 mol/L | D.0.4 mol/L |
下列叙述正确的是(双选)( )。
| A.1 mol·L-1 NaCl溶液含有NA个Na+ |
| B.10 mL质量分数为98%的H2SO4用水稀释至100 mL,H2SO4的质量分数应大于9.8% |
| C.配制240 mL 1 mol·L-1的NaOH溶液需称NaOH固体的质量为10.0 g |
| D.配制1 mol·L-1的H2SO4溶液时,将量取的浓H2SO4放入容量瓶中加水稀释 |
在200 mL某硫酸盐溶液中,含有1.5NA个硫酸根离子(NA表示阿伏加德罗常数的值),同时含有NA个金属离子。则该硫酸盐的物质的量浓度为( )
| A.2 mol·L-1 | B.2.5 mol·L-1 | C.5 mol·L-1 | D.7.5 mol·L-1 |