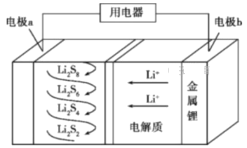
题目内容
【题目】将0.4mol·L-1HA溶液与0.2mol·L-1NaOH溶液等体积混合,测得混合溶液中c(Na+)﹥c(A-),则:
(1)混合溶液中c(A-)_________c(HA)(填“﹥”“﹤”或“=”)
(2)混合溶液中c(HA)+ c(A-)__________0.2mol·L-1(填“﹥”“﹤”或“=”)
(3)25℃时,如果取0.4 mol·L-1HA溶液与0.2mol·L-1NaOH溶液等体积混合,若测得混合溶液的pH=8,则c(Na+)-c(A-)=___________。(填准确数值)
【答案】 < = 9.9×10-7 mol·L-1
【解析】试题分析:本题考查溶液中粒子浓度的大小关系。将0.4mol·L-1HA溶液与0.2mol·L-1NaOH溶液等体积混合,反应后得到物质的量浓度均为0.1mol/L的HA和NaA的混合溶液,由于c(Na+)![]() c(A-),说明HA为弱酸,且混合液中HA的电离程度
c(A-),说明HA为弱酸,且混合液中HA的电离程度![]() A-的水解程度,溶液中粒子浓度由大到小的顺序为c(HA)
A-的水解程度,溶液中粒子浓度由大到小的顺序为c(HA)![]() (Na+)
(Na+)![]() c(A-)
c(A-)![]() c(OH-)
c(OH-)![]() c(H+)。
c(H+)。
(1)根据上述分析,c(A-)![]() c(HA)。
c(HA)。
(2)根据物料守恒,混合溶液中c(HA)+c(A-)=0.2mol/L。
(3)溶液中的电荷守恒为:c(Na+)+c(H+)=c(A-)+c(OH-),则c(Na+)-c(A-)=c(OH-)-c(H+)=1![]() 10-6mol/L-1
10-6mol/L-1![]() 10-8mol/L=9.9
10-8mol/L=9.9![]() 10-7mol/L。
10-7mol/L。

练习册系列答案
相关题目