题目内容
氨是一种重要的化工原料,氨的合成和应用是当前的重要研究内容之一。
(1)传统哈伯法合成氨工艺中相关的反应式为: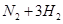


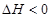 。
。
①该反应的平衡常数K的表达式为:K=_________。升高温度,K值________(填“增大”“减小”或“不变”)。
②不同温度、压强下,合成氨平衡体系中NH3的物质的量分数见下表(N2和H2的起始物质的量之比为1:3)。分析表中数据,__________(填温度和压强)时H2转化率最高,实际工业生产不选用该条件的主要原因是________________。
③下列关于合成氨说法正确是___________(填字母)
A. 使用催化剂可以提高氮气的转化率
B. 寻找常温下的合适催化剂是未来研究的方向
C. 由于△H<0、△S>0,故合成氨反应一定能自发进行
(2)最近美国Simons等科学家发明了不必使氨先裂化为氢就可直接用于燃料电池的方法。它既有液氢燃料电池的优点,又克服了液氢不易保存的不足。其装置为用铂黑作为电极,加入电解质溶液中,一个电极通人空气,另一电极通入氨气。其电池反应为
你认为电解质溶液应显______性(填“酸性”、“中性”、“碱性”),写出负极电极反应式________。
(12分)(1)①K=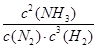 (1分) 减少(1分) ②200℃、100MPa(2分)
(1分) 减少(1分) ②200℃、100MPa(2分)
温度低速率慢,而压强太高生产设备条件难以实现(2分) ③B(2分)
(2)碱性(2分) 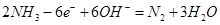 (2分)
(2分)
解析试题分析:(1)①化学平衡常数是在一定条件下,当可逆反应达到平衡状态时,生成物浓度的幂之积和反应物浓度的幂之积的比值,则根据反应的方程式可知,该反应的平衡常数K=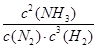 。正方应是放热反应,升高温度,平衡向逆反应方向移动,所以K值减小。
。正方应是放热反应,升高温度,平衡向逆反应方向移动,所以K值减小。
②根据表中数据可知,在温度为200℃、压强为100MPa时,氨气的含量最高。由于温度低速率慢,而压强太高生产设备条件难以实现,所以实际工业生产不选用该条件。
③催化剂不能改变平衡状态,只能改变反应速率,A不正确;寻找常温下的合适催化剂是未来研究的方向,B正确;根据方程式可知,该反应的熵值是减小,需要在一定条件下才能自发进行的,C不正确,答案选B。
(2)由于氨气是碱性气体,能和酸反应生成铵盐,所以电解质溶液应显碱性。原电池中负极失去电子,发生氧化反应,则氨气在负极通入,电极反应式是2NH3-6e-+6OH-=N2+3H2O。
考点:考查化学平衡常数、外界条件对平衡状态的影响、工业生产条件的控制以及原电池电极反应式的书写等
点评:该题是高考中的常见考点和题型,属于中等难度试题的考查,试题综合性强,侧重对学生能力的培养和解题方法的指导与训练,旨在考查学生灵活运用基础知识解决实际问题的能力,有利于培养学生的逻辑推理能力和发散思维能力,提升学生的学科素养。

下列关于化工生产的叙述中,符合目前工业生产实际的是
| A.石油工业中,采用干馏的方法把石油分成不同沸点范围的产品 |
| B.硝酸工业中,为了加快氨氧化的速率,通常使用铁触媒作催化剂 |
| C.纯碱工业中,氨碱法通过氨气和二氧化碳的循环利用,提高了原料的利用率 |
| D.合成氨工业中,采用高压条件,增大合成氨反应的平衡常数,增大原料转化率 |
【化学与技术】
世界环保联盟建议全面禁止使用氯气用于饮用水的消毒,而建议采用高效“绿色”消毒剂二氧化氯。二氧化氯是一种极易爆炸的强氧化性气体,易溶于水、不稳定、呈黄绿色,在生产和使用时必须尽量用稀有气体进行稀释,同时要避免光照、震动或加热。实验室以电解法制备ClO2的流程如下:请回答下列问题。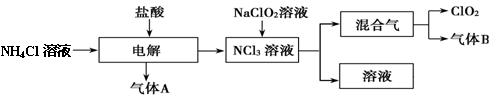
(1)ClO2中所有原子 (填“是”或“不是”)都满足8电子结构。上图所示电解法制得的产物中杂质气体B能使石蕊试液显蓝色,除去杂质气体可选用 。
A饱和食盐水 B碱石灰 C浓硫酸 D蒸馏水
(2)稳定性二氧化氯是为推广二氧化氯而开发的新型产品,下列说法正确的是 。
| A.二氧化氯可广泛用于工业和饮用水处理 |
| B.应用在食品工业中能有效地延长食品贮藏期 |
| C.稳定性二氧化氯的出现大大增加了二氧化氯的使用范围 |
| D.在工作区和成品储藏室内,要有通风装置和监测及警报装置 |
(4)我国广泛采用经干燥空气稀释的氯气与固体亚氯酸钠(NaClO2)反应制备,化学方程式是 ,此法相比欧洲方法的优点是 。
(5)科学家最近又研究出了一种新的制备方法,利用硫酸酸化的草酸(H2C2O4)溶液还原氯酸钠,化学反应方程式为 ,此法提高了生产及储存、运输的安全性,原因是 。
下面是人们对于化学科学的各种常见认识,其中错误的是( )。
| A.化学将在能源、资源的合理开发和安全应用方面大显身手 |
| B.化学是在被运用于破坏环境而没有治理环境污染 |
| C.化学是一门具有极强实用性的科学 |
| D.化学是一门以实验为基础的自然科学 |

 ,若在上述条件下,把l000ag CaCO3和60ag SiO2混合,则生成的CO2在标准状况下的体积为 (用含a的代数式表示)。
,若在上述条件下,把l000ag CaCO3和60ag SiO2混合,则生成的CO2在标准状况下的体积为 (用含a的代数式表示)。