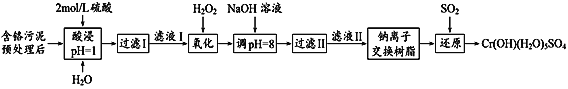
题目内容
【题目】如图为从光盘中提取Ag(其它金属微量忽略不计)对废旧资源进行回收利用的工艺流程,下列说法错误的是( )
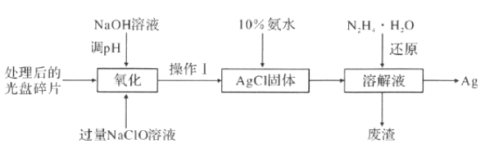
A.“氧化"阶段需在80 ℃条件下进行,则适宜的加热方式为水浴加热
B.“氧化“过程还生成O2,则反应方程式为4Ag+4NaClO+2H2O=4AgCl+ 4NaOH+O2↑
C.10%的氨水洛解AgCl团体,AgCl与NH3·H2O按1:2反应可生成Cl-和[Ag(NH3)2]+
D.“还原”过程中N2H4·H2O在碱性条件下转化为无害气体N2,则理论上生成22.4LN2可提取到43.2g的单质Ag。
【答案】D
【解析】
A. “氧化"阶段需在80 ℃条件下进行,不高于水的沸点可以采用水浴加热。水浴加热比起酒精灯加热,它的优点是受热均匀温度可控,A说法正确;
B.通过流程图可知“氧化"阶段加入氢氧化钠调pH提供碱性条件,光盘碎片中的Ag经氧化得到AgCl,加入过量的NaClO做氧化剂自身被还原为Cl(AgCl),根据氧化还原化合价规律,AgCl化合价按照整体处理原则,银元素从0→+1,氯元素从+1→-1,1个AgCl共降低1个,整个化学反应中能上升的只有氧元素,从-2→0,产物以氧气分子形式存在,每个氧气分子化合价上升4,故参与反应的AgCl与氧气的量比为4:1,那么涉及到氧化还原的部分为4Ag+4NaClO→4AgCl+ O2↑,再按照质量守恒可得4Ag+4NaClO+2H2O=4AgCl+ 4NaOH+O2↑,B说法正确;
C. 10%的氨水洛解AgCl固体,Ag+ 作为中心配离子提供空轨道,氮原子提供孤对电子,二者形成较为稳定的二配体,则AgCl与NH3·H2O按1:2反应:AgCl+2NH3·H2O![]() [Ag(NH3)2]+ + Cl,C说法正确;
[Ag(NH3)2]+ + Cl,C说法正确;
D. “还原”过程中N2H4·H2O在碱性条件下转化为无害气体N2,氮元素从-2→0,每个氮气分子化合价上升4,[Ag(NH3)2]+被还原为Ag,银元素从+1→0,每个银单质子化合价降低1,根据化合价升降守恒,n(N2):n(Ag)=1:4,则标况下生成22.4LN2为1mol,可提取单质Ag物质的量为0.4mol,质量为43.2g。题目没有说明22.4LN2处于标况,则不一定能转化为1mol,那么生成的银单质无法确定质量,D说法错误;
答案选D。

【题目】Ⅰ.室温下,将一元酸HA的溶液和KOH溶液等体积混合(忽略混合后溶液的体积变化),实验数据如下表:
实验序号 | 起始浓度/(mol·L-1) | 反应后溶液的pH | |
c(HA) | c(KOH) | ||
① | 0.1 | 0.1 | 9 |
② | x | 0.2 | 7 |
请回答:
(1)HA溶液和KOH溶液反应的离子方程式为________。
(2)实验①反应后的溶液中由水电离出的c(OH-)=________mol·L-1;x________0.2mol·L-1(填“>”“<”或“=”)。
(3)下列关于实验②反应后的溶液说法不正确的是________(填字母)。
a.溶液中只存在着两个平衡
b.溶液中:c(A-)+c(HA)>0.1mol·L-1
c.溶液中:c(K+)=c(A-)>c(OH-)=c(H+)
Ⅱ.已知2H2(g)+O2(g)=2H2O(1) ΔH=-572kJ·mol-1。某氢氧燃料电池以疏松多孔石墨棒为电极,KOH溶液为电解质溶液。
(4)写出该电池工作时负极的电极反应式________。
(5)若该氢氧燃料电池每释放228.8kJ电能时,会生成1mol液态水,则该电池的能量转化率为________。