题目内容
【题目】磷化氢(PH3)是一种剧毒气体,是最常用的高效熏蒸杀虫剂,也是一种电子工业原料。
(1)PH3的电子式为______________。
(2)在密闭粮仓放置的磷化铝(AlP)片剂,遇水蒸气放出PH3气体,该反应的化学方程式为:_____。
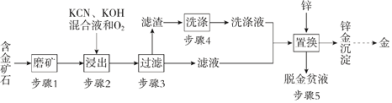
(3)PH3的一种工业制法涉及的物质转化关系如下图所示:

①次磷酸属于____元酸,亚磷酸属于____元酸;
②当反应I生成的n(NaH2PO2):n(Na2HPO3) =3:1时,参加反应的n(P4):n(NaOH)= ____。
(4)一种用于处理PH3废气的吸收剂成分为次氯酸钙80%、锯木屑(疏松剂)15%、活性炭 2.5%、滑石粉(防结块)2.5%。
①次氯酸钙将PH3氧化为H3PO4的化学方程式为_______________________________;
②空气中的水蒸气可加快PH3的氧化过程,其原因可能是_______________________。
(5)从(4)中的吸收残留物中回收磷酸氢钙(CaHPO4)的方法如下:

①试剂x为_________填化学式);
②已知25℃时,H3 PO4的Kal=7.5×10-3、Ka2=6.3×10-8、Ka3 =4.4×10-13。加入Y时,应控制悬浊液pH____7(填“>”、“=”或“<”),通过计算说明理由:________________________________
【答案】![]() AlP +3H2O =Al(OH)3+PH3↑ 一 二 3:10 2Ca(ClO)2 +PH3 ==H3PO4 +2CaCl2 次氯酸钙与水接触,水解生成氧化能力更强的HClO Ca(OH)2或CaO > HPO42-水解程度大于电离程度,溶液显碱性
AlP +3H2O =Al(OH)3+PH3↑ 一 二 3:10 2Ca(ClO)2 +PH3 ==H3PO4 +2CaCl2 次氯酸钙与水接触,水解生成氧化能力更强的HClO Ca(OH)2或CaO > HPO42-水解程度大于电离程度,溶液显碱性
【解析】
(1)PH3为共价化合物;
(2)AlP固体和水反应时,生成PH3和Al(OH)3;
(3)①由流程可知黄磷与足量的NaOH溶液反应只生成次磷酸钠NaH2PO2和亚磷酸钠Na2HPO3;
②该反应的反应物为黄磷、氢氧化钠,产物为次磷酸钠、亚磷酸钠,依据得失电子数目守恒计算;
(4)①漂白粉主要成分为CaCl2和Ca(ClO)2,Ca(ClO)2具有强氧化性;
②含有水蒸气时,次氯酸钙与水接触,水解生成氧化能力更强的HClO;
(5)①根据流程,加入试剂得到磷酸钙,所以试剂X含有钙离子,加入试剂能够中和磷酸氢钙中的氢;
②CaHPO4为强碱弱酸酸式盐,HPO42-的电离常数Ka3 =4.4×10-13,HPO42-的水解常数为![]() =
=![]() >Ka3 =4.4×10-13。
>Ka3 =4.4×10-13。
(1)PH3为共价化合物,电子式为![]() ,故答案为:
,故答案为:![]() ;
;
(2)AlP固体和水反应时,生成PH3和Al(OH)3,反应的化学方程式为:AlP+3H2O=Al(OH)3+PH3↑,故答案为:AlP+3H2O=Al(OH)3+PH3↑;
(3)①由流程可知黄磷与足量的NaOH溶液反应只生成次磷酸钠NaH2PO2和亚磷酸钠Na2HPO3,说明次磷酸为一元酸,亚磷酸为二元酸,故答案为:一;二;
②该反应的反应物为黄磷、氢氧化钠,产物为次磷酸钠、亚磷酸钠,P4中(P为0价),NaH2PO2中(P为+1价),Na2HPO3(P为+3价),PH3(P为-3价),当反应Ⅰ生成的n(NaH2PO2)∶n(Na2HPO3)=3∶1时,根据得失电子守恒,n(NaH2PO2)∶n(Na2HPO3)∶n(PH3)=3∶1∶2,反应为:3P4+10NaOH===6NaH2PO2+2Na2HPO3+4PH3↑,所以参加反应的n(P4)∶n(NaOH)=3∶10,故答案为:3∶10;
(4)①漂白粉主要成分为CaCl2和Ca(ClO)2,Ca(ClO)2具有强氧化性,能将PH3氧化为H3PO4,反应的化学方程式为2Ca(ClO)2+PH3=H3PO4+2CaCl2,故答案为:2Ca(ClO)2+PH3=H3PO4+2CaCl2;
②含有水蒸气时,次氯酸钙与水接触,水解生成氧化能力更强的HClO,加快PH3的氧化过程,故答案为:次氯酸钙与水接触,水解生成氧化能力更强的HClO;
(5)①根据流程,加入的试剂X使吸收液中的磷酸转化为磷酸钙,所以试剂X含有钙离子,加入试剂能够中和磷酸,需加入Ca(OH)2,CaO与水反应生成Ca(OH)2,所以X可以为Ca(OH)2或CaO,故答案为:Ca(OH)2或CaO;
②试剂Y可以把磷酸钙转化为磷酸氢钙,故Y为磷酸。CaHPO4为强碱弱酸的酸式盐,HPO42-的电离常数Ka3 =4.4×10-13,HPO42-的水解常数为![]() =
=![]() >Ka3 =4.4×10-13,水解程度大于电离程度,故CaHPO4溶液呈碱性,所以加入Ca(OH)2或CaO时,应控制悬浊液pH>7,有利于CaHPO4生成,故答案为:>;水解程度大于电离程度,溶液显碱性。
>Ka3 =4.4×10-13,水解程度大于电离程度,故CaHPO4溶液呈碱性,所以加入Ca(OH)2或CaO时,应控制悬浊液pH>7,有利于CaHPO4生成,故答案为:>;水解程度大于电离程度,溶液显碱性。

【题目】丙烷脱氢是工业生产丙烯的重要途径,其热化学方程式为:C3H8(g) ![]() C3H6(g)+H2(g) ΔH。请回答下列相关问题。
C3H6(g)+H2(g) ΔH。请回答下列相关问题。
(1)下表为部分键能数据,据此可算出△H=_________kJ/mol。
化学键 | C—C | C=C | C—H | H—H |
键能(kJ/mol) | 332 | 611 | 414 | 436 |
(2)一定温度下,向2L的密闭容器中充入2molC3H8发生脱氢反应,经过10min达到平衡状态,测得平衡时气体压强是开始的1.4倍。
①0~10 min内氢气的生成速率v(H2)=__________,C3H8的平衡转化率为_________。
②下列情况能说明该反应达到平衡状态的是___________。
A.混合气体的平均分子量保持不变
B. C3H6与H2的物质的量之比保持不变
C.混合气体的密度保持不变
D. C3H8的分解速率与C3H6的消耗速率相等
(3)脱氢反应分别在压强为p1和p2时发生,丙烷及丙烯的平衡物质的量分数随温度变化如图所示。

①压强:p1______p2(填“>”或“<”)。
②为了同时提高反应速率和反应物的平衡转化率,可采取的措施是__________。
③若p1=0.1 MPa,起始时充入丙烷发生反应,则Q点对应温度下,反应的平衡常数Kp_____(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
④在恒温、恒压的密闭容器中充入丙烷和氩气发生脱氢反应,起始n(氩气)/n(丙烷)越大,丙烷的平衡转化率越大,其原因是___________________。