题目内容
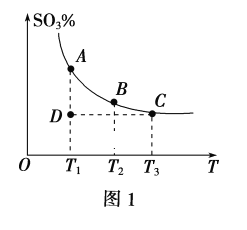
【题目】某工业废气中的SO2经如下图中的两个循环可分别得到S和H2SO4,假设循环I、II处理等质量的SO2。下列说法正确的是

A. “反应1”和“电解”中的氧化产物分别是ZnFeO3.5和MnO2
B. “反应2”和“吸收”中的SO2均起还原剂的作用
C. 铁网或石墨均可作为循环II中电解过程中的阳极材料
D. 循环I、II中理论上分别得到S和H2SO4的物质的量比为1∶1
【答案】D
【解析】
本题考查了氧化还原反应原理,还原剂判断,电极材料选取和工业流程图分析。
A. 由图可知,“反应1”是ZnFeO4与H2反应生成ZnFeO3.5,ZnFeO4化合价降低,发生还原反应,还原产物是ZnFeO3.5;“电解”是硫酸锰电解生成硫酸和二氧化锰,硫酸锰发生氧化反应,氧化产物是MnO2,A错误;
B. “反应2”中二氧化硫转化为硫单质,SO2发生还原反应,是氧化剂;“吸收”中SO2转化为硫酸根,发生氧化反应,是还原剂,B错误;
C. 金属作为循环II中电解过程中的阳极材料时,参与电解反应,故不能用铁丝,C错误;
D. 由于二氧化硫转化为硫单质或硫酸根,根据S守恒可知,n(S)=n(H2SO4),D正确。
答案为D。

练习册系列答案
相关题目
【题目】下列实验操作及对应解释或结论正确的是![]()
选项 | 实验操作 | 解释或结论 |
A | 向某溶液中滴加盐酸酸化的 | 原溶液中一定含有 |
B | 将 |
|
C | 用蒸馏水润湿的pH试纸测溶液的pH | 一定会使测定结果偏低 |
D | 向混有乙酸和乙醇的乙酸乙酯中加入氢氧化钠溶液 | 除去溶液中的乙酸和乙醇 |
A.AB.BC.CD.D