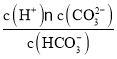题目内容
【题目】运用化学反应原理研究化学反应有重要意义。
(1)硫酸生产中,SO2催化氧化生成SO3:2SO2(g)+O2(g)![]() 2SO3(g),混合体系中SO3的百分含量和温度的关系如图1所示(曲线上任何一点都表示平衡状态)。
2SO3(g),混合体系中SO3的百分含量和温度的关系如图1所示(曲线上任何一点都表示平衡状态)。
①若在恒温、恒压条件下向上述平衡体系中通入氦气,平衡___(填“向左”“向右”或“不”)移动。
②若反应进行到状态D时,v正___(填“>”“<”或“=”)v逆。
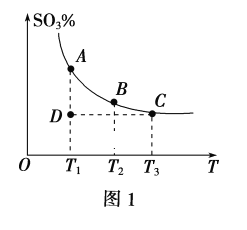
(2)已知N2(g)+3H2(g)![]() 2NH3(g) ΔH<0,在某温度下,2L的密闭容器中发生合成氨的反应,图2表示N2的物质的量随时间的变化曲线。用H2表示0~10min内该反应的平均速率v(H2)=__。从第11min起,压缩容器的体积为1L,则n(N2)的变化曲线为___(填编号)。
2NH3(g) ΔH<0,在某温度下,2L的密闭容器中发生合成氨的反应,图2表示N2的物质的量随时间的变化曲线。用H2表示0~10min内该反应的平均速率v(H2)=__。从第11min起,压缩容器的体积为1L,则n(N2)的变化曲线为___(填编号)。
(3)298K时,将20mL3xmol·L-1 Na3AsO3、20mL3xmol·L-1I2和20 mLNaOH溶液混合,发生反应:AsO33-(aq)+I2(aq)+2OH-(aq)![]() AsO43-(aq)+2I-(aq)+H2O(l)。溶液中c(AsO43-)与反应时间(t)的关系如图所示。
AsO43-(aq)+2I-(aq)+H2O(l)。溶液中c(AsO43-)与反应时间(t)的关系如图所示。
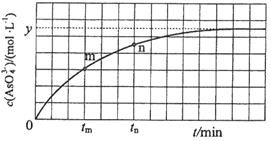
①下列可判断反应达到平衡的是___(填标号)。
a.溶液的pH不再变化 b.v(I-)=2v(AsO33-)
c.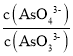 不再变化 d.c(I-)=y mol·L-1
不再变化 d.c(I-)=y mol·L-1
②tm时,v正___v逆(填“大于”“小于”或“等于”)。
③tm时v逆___tn时v逆(填“大于”“小于”或“等于”),理由是___。
【答案】向左 > 0.06mol/(Lmin) d ac 大于 大于 tm时生成物浓度较低反应速率较慢
【解析】
(1)①恒温、恒压条件下向上述平衡体系中通入氦气,体积应增大,反应混合物各组分的浓度降低;
②由图可知,温度越高,混合体系中SO3的百分含量越小,说明升高温度平衡向逆反应进行,升高温度向吸热反应方向移动;
(2)根据v=![]() 计算v(N2),再根据速率之比等于化学计量数之比计算v(H2);压缩体积,增大压强,平衡向正反应移动,改变瞬间n(N2)不变,达平衡是n(N2)减小;
计算v(N2),再根据速率之比等于化学计量数之比计算v(H2);压缩体积,增大压强,平衡向正反应移动,改变瞬间n(N2)不变,达平衡是n(N2)减小;
(3)①达到平衡时,正逆反应速率相等,各物质的浓度不变;
②反应从正反应开始进行,tm时反应继续正向进行;
③物质的浓度越大,反应速率越大。
(1)①恒温、恒压条件下向上述平衡体系中通入氦气,体积应增大,反应混合物各组分的浓度降低,等效为降低压强,正逆反应速率都减小,压强降低平衡向体积增大方向移动,即向左移动;
②反应进行到状态D时,没有达到平衡状态,反应的趋势是向生成SO3的方向进行,即向正反应方向移动,则v正>v逆。
(2)由图2可知,0~10min内氮气的物质的量变化为0.6mol-0.2mol=0.4mol,所以v(N2)= =0.02mol/(Lmin),速率之比等于化学计量数之比,所以v(H2)=3v(N2)=3×0.02mol/(Lmin)=0.06mol/(Lmin);压缩体积,增大压强,平衡向正反应移动,改变瞬间n(N2)不变,平衡时n(N2)减小,则n(N2)的变化曲线选d;
=0.02mol/(Lmin),速率之比等于化学计量数之比,所以v(H2)=3v(N2)=3×0.02mol/(Lmin)=0.06mol/(Lmin);压缩体积,增大压强,平衡向正反应移动,改变瞬间n(N2)不变,平衡时n(N2)减小,则n(N2)的变化曲线选d;
(3)①a.溶液pH不变时,则c(OH-)也保持不变,反应达到平衡状态,故a正确;
b.同一个化学反应,速率之比等于化学计量数之比,无论是否达到平衡,都存在v(I-)=2v(AsO33-),故b错误;
c.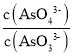 不再变化,可说明各物质的浓度不再变化,反应达到平衡状态,故c正确;
不再变化,可说明各物质的浓度不再变化,反应达到平衡状态,故c正确;
d.由图可知,当c(AsO43-)=ymolL-1时,浓度不再发生变化,则达到平衡状态,由方程式可知此时c(I-)=2ymolL-1,所以c(I-)=ymolL-1时没有达到平衡状态,故d错误;
故答案为:ac;
②反应从正反应开始进行,tm时反应继续正向进行,则v正大于v逆
③tm时比tn时浓度更小,则逆反应速率更小,故tm时v逆小于tn时v逆。

【题目】下列有关实验操作、现象和结论均正确的是
选项 | 实 验 操 作 及 现 象 | 实 验 结 论 |
A | 将水蒸气通过灼热的铁粉,粉末变红褐色 | 铁与水在高温下发生反应 |
B | 向某溶液中加入几滴新制的氯水,再加入2滴KSCN溶液,溶液变为红色 | 原溶液中不一定含有 |
C | 将某气体通入酸性高锰酸钾溶液中,溶液紫色褪去 | 该气体有还原性 |
D | 用pH试纸测定NaClO溶液的酸碱性,试纸显蓝色 | NaClO水解显碱性 |
A.AB.BC.CD.D