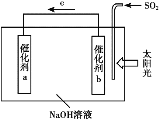
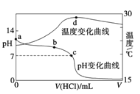
��Ŀ����
����Ŀ����1����������Ҫ�Ļ���ԭ�ϣ���Ҫ�������ʡ��䶳���ȡ�����һ�̶��ݻ��ķ�Ӧ����ͨ��2molN2��6molH2�ڴ��������¼�����ƽ��״̬����ô�ʱ������ѹǿ�ȷ�Ӧǰ��С��![]() ����ʽ����H2��ƽ��ת����___��
����ʽ����H2��ƽ��ת����___��
��2��ȼ�ϵ�ȼ�ս���ѧ��ת�������ܣ��ṩ����������ͷ�չ����Ҫ�������Ͷ������ֽ������8.96L�������ϩ�Ļ�����������������ֻ�ϲ���ȼ��ȼ�ղ��ᆳ��Ũ���������պ�����16.2g�������������������ϩ�����ʵ���֮��Ϊ����___��
���𰸡�40% 1:3
��������
��1���跴Ӧ�ﵽƽ��ʱ��������Ӧ��xmol��
N2(g)+3H2(g)![]() 2NH3(g)
2NH3(g)
��ʼ(mol) 2 6 0
�仯(mol) x 3x 2x
ƽ��(mol) (2-x) (6-3x) 2x
�������⣬��![]() �����x=0.8��
�����x=0.8��
������ƽ��ת����![]() ��
��
��2��������������������ʵ���Ϊxmol����ϩ�����ʵ���Ϊymol
![]() ��
��
![]() ��
��
��������x+y=0.4��3x+2y=0.9��
���y=0.3��x=0.1���ʻ���������������ϩ�����ʵ���֮��Ϊ1:3��

��ϰ��ϵ�д�
�����Ŀ