题目内容
金属钛(Ti)性能优越,被称为继铁、铝后的“第三金属”。工业上以金红石为原料制取Ti的反应为
aTiO2+bCl2+cC aTiCl4+cCO反应(1)
aTiCl4+cCO反应(1)
TiCl4+2Mg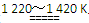 Ti+2MgCl2反应(2)
Ti+2MgCl2反应(2)
关于反应(1)、(2)的分析不正确的是( )
①TiCl4在反应(1)中是还原产物,在反应(2)中是氧化剂;
②C、Mg在反应中均为还原剂,被还原;
③在反应(1)、(2)中的还原性C>TiCl4,Mg>Ti;
④a=1,b=c=2;
⑤每生成19.2 g Ti(Mr=48),反应(1)、(2)中共转移4.8 mol e-。
A.①②④ B.②③④ C.③④ D.②⑤
D
解析

在加热时,浓硫酸与铜发生反应的化学方程式为:2H2SO4(浓)+Cu  CuSO4+SO2↑+2H2O,对于该反应,下列说法中不正确的是
CuSO4+SO2↑+2H2O,对于该反应,下列说法中不正确的是
| A.是氧化还原反应 | B.浓硫酸是还原剂 |
| C.H2SO4表现了氧化性和酸性 | D.反应中Cu发生了氧化反应 |
三氟化氮(NF3)在微电子工业中有重要用途,可由氨气和氟气反应得到,它在潮湿的空气中与水蒸气反应的产物有HF、NO和HNO3。下列说法错误的是
| A.原子半径:N>F |
| B.在与水蒸气反应中,NF3既是氧化剂又是还原剂 |
| C.若NF3泄漏,可用石灰水溶液喷淋的方法减少污染 |
| D.在潮湿空气中反应,被氧化与被还原的元素的物质的量之比为2:1 |
氧化还原反应与四种基本类型反应的关系如右图所示,则下列化学反应属于4区的是( )。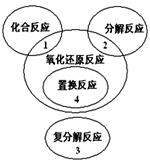
| A.Cl2+2KBr=Br2+2KCl |
| B.2NaHCO3=Na2CO3+H2O+CO2 |
| C.4Fe(OH)2+O2+2H2O=4Fe(OH)3 |
| D.2Na2O2+2CO2=2Na2CO3+O2 |
液态金属汞常温下即可蒸发,其蒸气有剧毒, 实验室为监测空气中汞蒸气的含量,通常悬挂有CuI的滤纸,根据滤纸是否变色或颜色发生变化的时间来判断空气中汞的含量,其反应为:
4CuI+Hg= Cu2HgI4+2Cu(I的化合价反应前后均为-1价的)。下列有关说法不正确的是( )
| A.上述反应的产物Cu2HgI4中,Hg的化合价为+2 |
| B.上述反应中氧化剂是CuI |
| C.上述反应中Cu元素仅有一半被还原 |
| D.上述反应中生成64gCu时,转移的电子数为2NA |
LiAlH4是重要的储氢材料,其组成类似于Na3AlF6。常见的供氢原理如下面两个方程式所示:
①2LiAlH4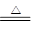 2LiH+2Al+3H2↑
2LiH+2Al+3H2↑
②LiAlH4+2H2O=LiAlO2+4H2↑
下列说法正确的是( )
| A.LiAlH4是共价化合物,LiH是离子化合物 |
| B.生成等质量的氢气,反应①、②转移电子数之比为4?3 |
| C.氢化锂也是一种储氢材料,供氢原理为LiH+H2O=LiOH+H2↑ |
| D.若反应①中生成3.36 L氢气,则一定有2.7 g铝生成 |
向100 mL 18 mol/L的硫酸中加入足量铜片,加热并充分反应。下列有关说法正确的是( )
| A.充分反应后转移1.8 mol电子 |
| B.H2SO4只作氧化剂 |
| C.若不加热应生成H2 |
| D.消耗的铜的质量一定少于57.6 g |
在熔融KOH中,大气中的氧可将铬铁矿(FeCr2O4)中Fe和Cr的化合价都转化为+6价,氧化1 mol FeCr2O4在理论上需要氧气( )
| A.2 mol | B.2.5 mol | C.3 mol | D.4 mol |
工业上可用硫酸铝与硫黄焙烧制备氧化铝:2Al2(SO4)3+3S  2Al2O3+9SO2↑,下列有关说法中正确的是( )
2Al2O3+9SO2↑,下列有关说法中正确的是( )
| A.反应中Al2(SO4)3被氧化 |
| B.Al2(SO4)3、Al2O3均含有离子键和共价键 |
| C.5.1 g Al2O3含有9.03×1022个阴离子 |
| D.该反应中,每转移0.3 mol电子生成5.04 L SO2 |