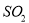题目内容
用惰性电极电解某金属元素R的硝酸盐R(NO3)n溶液,通电一段时间后,阳极产生气体V L(标准状况)时,阴极质量增加m g,若R的相对原子质量为M,设NA 为阿伏加德罗常数的值,下列叙述中不正确的是
A.电路中通过电子 NA B.n =
NA B.n = 
C.溶液中H+增加 NA D.n =
NA D.n = 
B
【解析】
试题分析:某金属元素R的硝酸盐R(NO3)n溶液,电解时由于放电能力OH-> NO3-,所以在阳极发生反应:4 OH--4e-=2H2O+O2↑,在阴极发生反应:Rn++ne-=R。A.在整个闭合回路中电子转移数目就是产生氧气时失去的电子数目,所以电路中通过电子(V÷22.4)×4NA=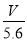 NA 。正确。B.根据电子得失数目相等可得(m÷M)×n=
NA 。正确。B.根据电子得失数目相等可得(m÷M)×n= ,所以n=
,所以n= 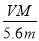 .错误。C.每转移电子1mol,就有1mol的OH-放电,同时得到1mol的H+,即溶液中的H+的物质的量增加1mol. 电路中通过电子
.错误。C.每转移电子1mol,就有1mol的OH-放电,同时得到1mol的H+,即溶液中的H+的物质的量增加1mol. 电路中通过电子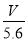 NA,所以溶液中H+增加
NA,所以溶液中H+增加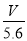 NA。正确。D.电子转移的物质的量
NA。正确。D.电子转移的物质的量 =(m÷M)n,整理可得n=
=(m÷M)n,整理可得n=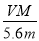 .正确。
.正确。
考点:考查电极产物及转移电子的物质的量的关系的知识。

练习册系列答案
 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案
相关题目
下表是元素周期表的一部分,X、Y、Z、W均为短周期元素,下列说法不正确的是( )
| X |
| Y |
Z |
| W |
|
A.原子半径:Z>W>X
B.若Z的最高价氧化物与Y的气态氢化物溶液混合后有气体放出,则W的气态氢化物不稳定
C.若Y、W的质子数之和为23,则Z能形成碱性氧化物
D.若X能形成两种常见的液态化合物,则W单质溶于水形成的溶液有漂白性