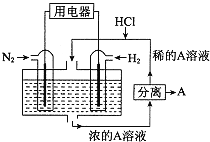
题目内容
【题目】下列离子方程式书写正确的是 ( )
A. 向水中通入氯气:Cl2+H2O![]() 2H++Cl-+ClO-
2H++Cl-+ClO-
B. 向氯化铁溶液中加入铜:2Fe3++3Cu===2Fe+3Cu2+
C. NH4HCO3溶液与过量KOH浓溶液共热:NH4++OH-![]() NH3↑+H2O
NH3↑+H2O
D. 向二氧化锰中滴加浓盐酸并加热:MnO2+4H++2Cl-![]() Mn2++Cl2↑+2H2O
Mn2++Cl2↑+2H2O
【答案】D
【解析】
A.次氯酸为弱电解质,不能拆;B.得失电子不守恒;C、缺少碳酸氢根离子与氢氧根离子反应生成碳酸根离子和水;D、实验室用二氧化锰跟浓盐酸加热反应制取氯气,生成氯化锰、氯气和水。
A.向水中通入氯气,离子方程式:Cl2+H2O═H++Cl-+HClO,选项A错误;B.向氯化铁溶液中加入铜,离子方程式:2Fe3++Cu═2Fe2++Cu2+,选项B错误;C.NH4HCO3溶液与过量KOH浓溶液共热,反应的离子方程式为NH4+++HCO3--+2OH-![]() NH3↑+CO32-+2H2O,选项C错误;D、向二氧化锰中滴加浓盐酸并加热:MnO2+4H++2Cl-
NH3↑+CO32-+2H2O,选项C错误;D、向二氧化锰中滴加浓盐酸并加热:MnO2+4H++2Cl-![]() Mn2++Cl2↑+2H2O,选项D正确。答案选D。
Mn2++Cl2↑+2H2O,选项D正确。答案选D。

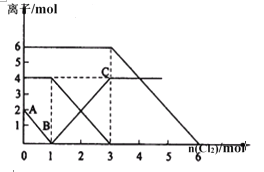
【题目】下列离子方程式的书写及评价均合理的是( )
选项 | 离子方程式 | 评价 |
A | 将2 mol Cl2通入含1 mol FeI2的溶液中: 2Fe2++2I-+2Cl2===2Fe3++4Cl-+I2 | 正确;Cl2过量,可将Fe2+、I-均氧化 |
B | Ba(HCO3)2溶液与足量的NaOH溶液反应: Ba2++HCO3-+OH-===BaCO3↓+H2O | 正确;酸式盐与碱反应生成正盐和水 |
C | 过量SO2通入NaClO溶液中: SO2+H2O+ClO-===HClO+HSO3- | 正确;说明酸性:H2SO3强于HClO |
D | 1 mol/L的NaAlO2溶液和2.5 mol/L的HCl溶液等体积混合: 2AlO2-+5H+===Al3++Al(OH)3↓+H2O | 正确;第一步反应和第二步反应消耗的H+的物质的量之比为2∶3 |
A. A B. B C. C D. D