题目内容
如图所示的实验装置,丙为用淀粉碘化钾和酚酞混合溶液润湿的滤纸,m、n为夹在滤纸两端的铂夹。丁为直流电源,x、y为电源的两极。G为电流计,电极均为石墨电极。闭合K2、断开K1,一段时间后,A、B两极产生的气体体积之比为2:1,回答下列问题:
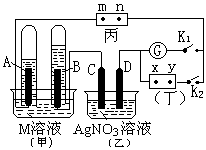
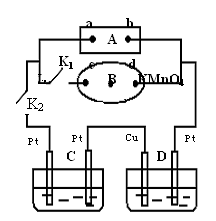
(1)M溶液可能是 (填序号)。
A.KNO3溶液 B. Ba(OH)2溶液 C.H2SO4溶液
D. NaCl溶液 E.CuSO4溶液
(2)X为电源 极,m点的现象 。
(3)C极的电极反应式为 。
(4)若乙池中AgNO3溶液电解后体积为100mL,测得溶 液的pH=1, 则乙池中C极析出的固体质量为 g。
(5)继续电解一段时间后,甲池中A、B极均部分被气体包围,此时闭合K1,断开K2,发现A、B极的管内气体体积减少,且电流计G指针发生偏转,则A极电极反应式为 。


(1)M溶液可能是 (填序号)。
A.KNO3溶液 B. Ba(OH)2溶液 C.H2SO4溶液
D. NaCl溶液 E.CuSO4溶液
(2)X为电源 极,m点的现象 。
(3)C极的电极反应式为 。
(4)若乙池中AgNO3溶液电解后体积为100mL,测得溶 液的pH=1, 则乙池中C极析出的固体质量为 g。
(5)继续电解一段时间后,甲池中A、B极均部分被气体包围,此时闭合K1,断开K2,发现A、B极的管内气体体积减少,且电流计G指针发生偏转,则A极电极反应式为 。
(1)A、B、C(2)负 滤纸变红
(2)Ag++e- =Ag;(3)1.08;(4)H2-2e-==2H+。
(2)Ag++e- =Ag;(3)1.08;(4)H2-2e-==2H+。
据题意A、B两极产生的气体体积之比为2:1,可推知甲装置中实质是电解水,而且A极产生的是氢气,进一步可确定Y为电源的正极,X为电源的负极。据乙池电解反应式:4Ag++2H2O 4Ag+O2+4H+,n(Ag)=n(H+)=O.01mol,即可求出析出银的质量。当闭合K1,断开K2时,甲池形成原电池,A极为原电池的负极。
4Ag+O2+4H+,n(Ag)=n(H+)=O.01mol,即可求出析出银的质量。当闭合K1,断开K2时,甲池形成原电池,A极为原电池的负极。
 4Ag+O2+4H+,n(Ag)=n(H+)=O.01mol,即可求出析出银的质量。当闭合K1,断开K2时,甲池形成原电池,A极为原电池的负极。
4Ag+O2+4H+,n(Ag)=n(H+)=O.01mol,即可求出析出银的质量。当闭合K1,断开K2时,甲池形成原电池,A极为原电池的负极。
练习册系列答案
 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案 名校名师培优作业本加核心试卷系列答案
名校名师培优作业本加核心试卷系列答案
相关题目
 方程式
方程式  。
。