��Ŀ����
A��B��C��D��E�������ʾ�����ͬһ��Ԫ�أ�����֮��������ת����ϵ��
��1����AΪ���ʣ�B��C���������࣬B��ˮ��Һ�����ԣ�C��ˮ��Һ�ʼ��ԣ�D��һ�ְ�ɫ������д�����й��̵����ӷ���ʽ��

��B��ˮ��Һ������____________�� ��C��D_______________�� ��E��C________________��
��2����A��E��Ϊ�����A�ǵ���ɫ���壻B��C����Һ�ڵ����ʵ���Ũ��ʱ��C ��Һ��pH��С�����D��ˮ��Һ������Ҫ�Ĺ�ҵ����֮һ��D��E��CҲ�ǹ�ҵ�Ʊ�C���ձ鷽����
��A�ĵ���ʽΪ__________��
�ڵ��D��ˮ��Һʱ����Ӧ�����ӷ���ʽΪ________________��
����������D��Һ��������ʴ�������ĵ缫��ӦΪ________________��
��3����AΪ���ʣ�C��D����Է����������16��0.1mol/L E��Һ��ֻ��3�����ӣ��ҳ�������Һ�е� =1012��
=1012��
��B��C�Ļ�ѧ����ʽΪ�� ��
��A��C�ķ�Ӧ�У�ÿת��1 mol e-�ͻ�����45 kJ��д���÷�Ӧ���Ȼ�ѧ����ʽ�� ��
��1����AΪ���ʣ�B��C���������࣬B��ˮ��Һ�����ԣ�C��ˮ��Һ�ʼ��ԣ�D��һ�ְ�ɫ������д�����й��̵����ӷ���ʽ��

��B��ˮ��Һ������____________�� ��C��D_______________�� ��E��C________________��
��2����A��E��Ϊ�����A�ǵ���ɫ���壻B��C����Һ�ڵ����ʵ���Ũ��ʱ��C ��Һ��pH��С�����D��ˮ��Һ������Ҫ�Ĺ�ҵ����֮һ��D��E��CҲ�ǹ�ҵ�Ʊ�C���ձ鷽����
��A�ĵ���ʽΪ__________��
�ڵ��D��ˮ��Һʱ����Ӧ�����ӷ���ʽΪ________________��
����������D��Һ��������ʴ�������ĵ缫��ӦΪ________________��
��3����AΪ���ʣ�C��D����Է����������16��0.1mol/L E��Һ��ֻ��3�����ӣ��ҳ�������Һ�е�
 =1012��
=1012����B��C�Ļ�ѧ����ʽΪ�� ��
��A��C�ķ�Ӧ�У�ÿת��1 mol e-�ͻ�����45 kJ��д���÷�Ӧ���Ȼ�ѧ����ʽ�� ��
��1����Al3++3H2O  Al(OH)3+3H+�� ��AlO2-+H++H2O=Al(OH)3�� ��Al2O3+2OH-=2AlO2-+H2O
Al(OH)3+3H+�� ��AlO2-+H++H2O=Al(OH)3�� ��Al2O3+2OH-=2AlO2-+H2O
��2���� �� ��2Cl-+2H2O
�� ��2Cl-+2H2O H2��+Cl2��+2OH-�� ��O2+4e-+2H2O=4OH-
H2��+Cl2��+2OH-�� ��O2+4e-+2H2O=4OH-
��3����4NH3+5O2 4NO+6H2O ��N2(g)+O2(g)=2NO(g) ��H="+180" kJ/mol
4NO+6H2O ��N2(g)+O2(g)=2NO(g) ��H="+180" kJ/mol
 Al(OH)3+3H+�� ��AlO2-+H++H2O=Al(OH)3�� ��Al2O3+2OH-=2AlO2-+H2O
Al(OH)3+3H+�� ��AlO2-+H++H2O=Al(OH)3�� ��Al2O3+2OH-=2AlO2-+H2O��2����
 �� ��2Cl-+2H2O
�� ��2Cl-+2H2O H2��+Cl2��+2OH-�� ��O2+4e-+2H2O=4OH-
H2��+Cl2��+2OH-�� ��O2+4e-+2H2O=4OH-��3����4NH3+5O2
 4NO+6H2O ��N2(g)+O2(g)=2NO(g) ��H="+180" kJ/mol
4NO+6H2O ��N2(g)+O2(g)=2NO(g) ��H="+180" kJ/mol�����������1�������������֪��A��Al ; B:AlCl3; C:NaAlO2; D:Al(OH)3; E:Al2O3.��B��ˮ��Һ����������ΪAlCl3��ǿ�������Σ����������ˮ��������ˮ���������OH-�����յ���Һ�ﵽƽ��ʱ��C(H+)>C(OH-).ˮ������ӷ���ʽΪ��Al3++3H2O
 Al(OH)3+3H+ ��C��D AlO2-+H++H2O=Al(OH)3����E��C Al2O3+2OH-=2AlO2-+H2O
Al(OH)3+3H+ ��C��D AlO2-+H++H2O=Al(OH)3����E��C Al2O3+2OH-=2AlO2-+H2O��2�� ��A��E��Ϊ�����A�ǵ���ɫ���壻B��C����Һ�ڵ����ʵ���Ũ��ʱ��C ��Һ��pH��С�����D��ˮ��Һ������Ҫ�Ĺ�ҵ����֮һ��D��E��CҲ�ǹ�ҵ�Ʊ�C���ձ鷽���� ������ʷֱ��ǣ�A ��Na2O2; B :NaOH; C :Na2CO3;D : NaCl;E :NaHCO3. ��Na2O2�ĵ���ʽΪ
 .�ڵ�ⱥ��NaCl��ˮ��Һ�����ӷ���ʽΪ2Cl-+2H2O
.�ڵ�ⱥ��NaCl��ˮ��Һ�����ӷ���ʽΪ2Cl-+2H2O H2��+Cl2��+2OH-������������NaCl��Һ����������������ʴ�������ĵ缫��ӦΪO2+4e-+2H2O=4OH-�������ĵ缫ʽΪFe-2e-=Fe2+.
H2��+Cl2��+2OH-������������NaCl��Һ����������������ʴ�������ĵ缫��ӦΪO2+4e-+2H2O=4OH-�������ĵ缫ʽΪFe-2e-=Fe2+.��3����AΪ���ʣ�C��D����Է����������16��0.1mol/L E��Һ��ֻ��3�����ӣ��ҳ�������Һ�е�
 =1012����A��N2��B��NH3��C��NO��D��NO2��E��HNO3����B��C�Ļ�ѧ����ʽΪ��4NH3+5O2
=1012����A��N2��B��NH3��C��NO��D��NO2��E��HNO3����B��C�Ļ�ѧ����ʽΪ��4NH3+5O2 4NO+6H2O��A��C�ķ�Ӧ���Ȼ�ѧ����Ϊ��N2(g)+O2(g)=2NO(g) ��H="+180" kJ/mol��
4NO+6H2O��A��C�ķ�Ӧ���Ȼ�ѧ����Ϊ��N2(g)+O2(g)=2NO(g) ��H="+180" kJ/mol��
��ϰ��ϵ�д�
�����Ŀ
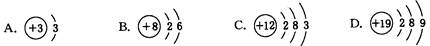

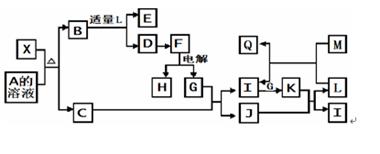

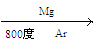 Ti
Ti