题目内容
16.下列物质属于电解质的是( )| A. | 碘酒 | B. | 液氯 | C. | HClO | D. | 氯水 |
分析 在水溶液里或融融状态下能导电的化合物是电解质,在水溶液里或熔融状态下都不能导电的化合物是非电解质,无论是电解质还是非电解质都必须是化合物,据此解答.
解答 解:A.碘酒属于混合物,既不是电解质也不是非电解质,故A错误;
B.液氯是单质,既不是电解质也不是非电解质,故B错误;
C.次氯酸在水溶液中能够导电,属于电解质,故C正确;
D.氯水属于混合物,既不是电解质也不是非电解质,D错误;
故选:C.
点评 本题考查了电解质和非电解质的判断,熟悉概念是解题关键,注意单质、混合物既不是电解质也不是非电解质,题目难度不大.

练习册系列答案
相关题目
6. 物质A~E在水中电离产生下列离子:
物质A~E在水中电离产生下列离子:
常温下将各物质的溶液从1ml稀释到1000ml,PH的变化关系如图所示,期中A和D反应生成E.请回答下列问题
(1)根据PH的变化关系,写出下列物质的化学式:BNaOH DCH3COOH
(2)写出A与C反应的离子方程式NH3+H+=NH4+
(3)25℃时0.1mol/L的NH4Cl溶液的PH=a,则NH4Cl溶液中c(H+)-c(NH3•H2O)=c(OH-)(用含a的关系式表示)
(4)H2SO4的酸式盐NH4HSO4,在NH4HSO4溶液中加入NaOH使溶液呈中性,则溶液中各离子浓度大小顺序为C(Na+)>C(SO42-)>C(NH4+)>C(H+)=C(OH-).
 物质A~E在水中电离产生下列离子:
物质A~E在水中电离产生下列离子:| 阳离子 | NH4+ H+ Na+ |
| 阴离子 | OH-CH3COO- SO42- |
(1)根据PH的变化关系,写出下列物质的化学式:BNaOH DCH3COOH
(2)写出A与C反应的离子方程式NH3+H+=NH4+
(3)25℃时0.1mol/L的NH4Cl溶液的PH=a,则NH4Cl溶液中c(H+)-c(NH3•H2O)=c(OH-)(用含a的关系式表示)
(4)H2SO4的酸式盐NH4HSO4,在NH4HSO4溶液中加入NaOH使溶液呈中性,则溶液中各离子浓度大小顺序为C(Na+)>C(SO42-)>C(NH4+)>C(H+)=C(OH-).
11.下列表达式正确的是( )
| A. | NaHCO3的电离:NaHCO3═H++CO32-+Na+ | |
| B. | Na2S的水解:S2-+2H2O?H2S+2OH- | |
| C. | CH3COONH4的电离:CH3COONH4═NH4++CH3COO- | |
| D. | FeCl3的水解:Fe3++3H2O?Fe(OH)3↓+3H+ |
6.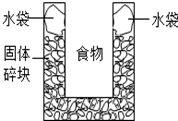 如图是一个一次性加热杯的示意图.当水袋破裂时,水与固体碎块混和,杯内食物温度明显上升.制造此加热杯可选用的固体碎块是( )
如图是一个一次性加热杯的示意图.当水袋破裂时,水与固体碎块混和,杯内食物温度明显上升.制造此加热杯可选用的固体碎块是( )
 如图是一个一次性加热杯的示意图.当水袋破裂时,水与固体碎块混和,杯内食物温度明显上升.制造此加热杯可选用的固体碎块是( )
如图是一个一次性加热杯的示意图.当水袋破裂时,水与固体碎块混和,杯内食物温度明显上升.制造此加热杯可选用的固体碎块是( )| A. | 硝酸铵 | B. | 食盐 | C. | 蔗糖 | D. | 生石灰 |
 ,氧化剂是MnO2还原剂是HCl(填化学式)
,氧化剂是MnO2还原剂是HCl(填化学式)