题目内容
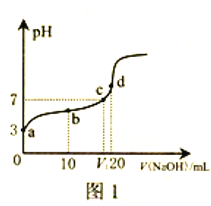
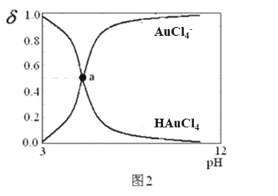
【题目】25℃时,向20mL0.1mol/LHAuCl4溶液中滴加0.1mol/LNaOH溶液,滴定曲线如图1,含氯微粒的物质的量分数(δ)随pH变化关系如图2,则下列说法不正确的是
A. 在c点溶液中:c(Na+)=c(AuCl4-)
B. a点对应溶液pH约为5
C. 25℃时,HAuCl4的电离常数为1×10-3
D. d点时,溶液中离子浓度大小关系为:c(Na+)>c(AuCl4-)>c(OH-)>c(H+)
【答案】C
【解析】c点溶液中,pH=7,c(OH-)=c(H+),根据电荷守恒可知:c(Na+)=c(AuCl4-),A正确;根据Ka= c(H+)×c(AuCl4-)/c(HAuCl4)=10-3×10-3/(0.1-10-3)≈10-5,由于a点时,c(AuCl4-)= c(HAuCl4),所以c(H+)≈10-5 mol/L, pH≈5,B正确;0.1mol/LHAuCl4溶液pH=3,根据HAuCl4=H++ AuCl4-可知,该反应的电离常数为Ka=c(H+)×c(AuCl4-)/c(HAuCl4)= 10-3×10-3/(0.1-10-3)=10-5,C错误;d点时,溶液溶质为NaAuCl4,溶液显碱性,所以溶液中离子浓度大小关系为:c(Na+)>c(AuCl4-)>c(OH-)>c(H+),D正确;正确选项C。

 阅读快车系列答案
阅读快车系列答案【题目】用NaOH标准溶液对某醋酸溶液的浓度进行标定。回答下列问题:
(1)实验用品有:0.2000 mol/L的NaOH溶液,醋酸溶液,蒸馏水;pH计,酸式滴定管,碱式滴定管,锥形瓶,烧杯,铁架台。还缺少的一种仪器是____________。
(2)为标定该醋酸溶液的准确浓度,用0.2000 mol/L的NaOH溶液对20.00 mL醋酸溶液进行滴定,几次滴定消耗NaOH溶液的体积如下:
实验序号 | 1 | 2 | 3 |
消耗NaOH溶液的体积(mL) | 20.05 | 20.00 | 19.95 |
该醋酸溶液的准确浓度为_____________(保留小数点后四位),上述标定过程中,造成测定结果偏高的原因可能是_______________。
A.未用标准液润洗碱式滴定管
B.滴定终点读数时,俯视滴定管的刻度,其它操作均正确
C.盛装未知液的锥形瓶用蒸馏水洗过,未用待测液润洗
D.滴定到终点读数时发现滴定管尖嘴处悬挂一滴溶液