题目内容
【题目】硒(Se)、碲(Te)的单质和化合物在化工生产等方面具有重要应用。
(1)下列关于硒、碲及其化合物的叙述不正确的是_______。
A.Te 位于周期表的第五周期 Ⅵ A 族
B.Se 的氧化物通常有SeO2和SeO3
C.H2TeO4的酸性比H2SO4的酸性强
D.热稳定性H2Se比H2S弱,但比HBr强
(2)25℃ 时,硒酸的电离H2SeO4=H+ +![]() ;
;![]() H+ +
H+ +![]() Ka2 = 1×10-3,则0.1 mol·L-1NaHSeO4溶液的pH约为________;NaHSeO4溶液中的物料守恒表达式为____________。
Ka2 = 1×10-3,则0.1 mol·L-1NaHSeO4溶液的pH约为________;NaHSeO4溶液中的物料守恒表达式为____________。
(3)TeO2微溶于水,易溶于较浓的强酸和强碱。工业上常用铜阳极泥(主要含TeO2,还含有少量Ag、Au)为原料制备单质碲,其工艺流程如图:
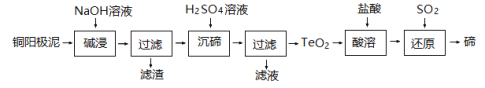
①铜阳极泥在碱浸前需烘干、研成粉末,目的是____________;
②“碱浸”时TeO2发生反应的化学方程式为_____________;
③“沉碲”时控制溶液的 pH 为 4.5~5.0,生成TeO2沉淀,酸性不能过强的原因是__________;
④“还原”得到固态碲为粗碲,对粗碲进行洗涤,判断洗涤干净的实验操作和现象是________。
【答案】C、D 2 c(Na+)=c(![]() )+ c(
)+ c(![]() ) 增大接触面积,加快浸取速率 TeO2+2NaOH=Na2TeO3+H2O TeO2会继续与酸反应,导致TeO2沉淀不完全 取最后一次洗涤液少许于试管中,加入过量HNO3溶液酸化,再加入AgNO3溶液,如果不出现白色沉淀,则说明已经洗干净。
) 增大接触面积,加快浸取速率 TeO2+2NaOH=Na2TeO3+H2O TeO2会继续与酸反应,导致TeO2沉淀不完全 取最后一次洗涤液少许于试管中,加入过量HNO3溶液酸化,再加入AgNO3溶液,如果不出现白色沉淀,则说明已经洗干净。
【解析】
碲与氧是同主族元素,由氧在元素周期表中的位置,可推断碲在周期表中的位置;由H2SeO4= H+ +![]() ,可推断出
,可推断出![]() 在水溶液中只发生电离,所以溶液中存在
在水溶液中只发生电离,所以溶液中存在![]() 和
和![]() 两种离子。铜阳极泥(主要含TeO2,还含有少量Ag、Au)中加入NaOH溶液碱溶,只有TeO2发生溶解生成Na2TeO3和水,Ag、Au不溶解而成为滤渣;滤液中加入硫酸,Na2TeO3转化为TeO2;再加入盐酸溶解生成TeCl4,再通SO2还原,从而得到碲。
两种离子。铜阳极泥(主要含TeO2,还含有少量Ag、Au)中加入NaOH溶液碱溶,只有TeO2发生溶解生成Na2TeO3和水,Ag、Au不溶解而成为滤渣;滤液中加入硫酸,Na2TeO3转化为TeO2;再加入盐酸溶解生成TeCl4,再通SO2还原,从而得到碲。
(1)A.Te 为52号元素,K、L、M、N、O层依次排有2、8、18、18、6个电子,位于周期表的第五周期 Ⅵ A 族,A正确;
B.Se 元素的最外层有6个电子,常见化合价有+4价、+6价、-2价,氧化物通常有SeO2和SeO3,B正确;
C.Te与S同主族且位于S的下方,非金属性Te<S,H2TeO4的酸性比H2SO4的酸性弱,C不正确;
D.Se与Br同周期,且Se位于Br的左边,非金属性Se<Br,所以H2Se比HBr弱,D不正确;
故选CD。答案为:CD;
(2)25℃ 时,硒酸的电离H2SeO4=H+ +![]() ;
;![]() H+ +
H+ +![]() Ka2= 1×10-3,则0.1 mol·L-1NaHSeO4溶液中,c(H+)=
Ka2= 1×10-3,则0.1 mol·L-1NaHSeO4溶液中,c(H+)=![]() mol=0.01mol/L,pH约为2;NaHSeO4溶液中,存在NaHSeO4=Na+ +
mol=0.01mol/L,pH约为2;NaHSeO4溶液中,存在NaHSeO4=Na+ +![]() ,
,![]() H+ +
H+ +![]() ,物料守恒表达式为c(Na+)=c(
,物料守恒表达式为c(Na+)=c(![]() )+ c(
)+ c(![]() )。答案为:
)。答案为:![]() )+ c(
)+ c(![]() );
);
(3)①为增大接触面积,铜阳极泥在碱浸前需烘干、研成粉末,目的是增大接触面积,加快浸取速率;
②“碱浸”时TeO2与NaOH发生反应生成Na2TeO3和H2O,发生反应的化学方程式为TeO2+2NaOH=Na2TeO3+H2O;
③题干信息显示,“TeO2易溶于较浓的强酸和强碱”,所以“沉碲”时控制溶液的 pH 为 4.5~5.0,生成TeO2沉淀,酸性不能过强的原因是TeO2会继续与酸反应,导致TeO2沉淀不完全;
④判断粗碲洗涤干净时,应检验表面是否吸附溶液中的Cl-等,可利用稀硝酸和AgNO3溶液,实验操作和现象是:取最后一次洗涤液少许于试管中,加入过量HNO3溶液酸化,再加入AgNO3溶液,如果不出现白色沉淀,则说明已经洗干净。
答案为:增大接触面积,加快浸取速率;TeO2+2NaOH=Na2TeO3+H2O;TeO2会继续与酸反应,导致TeO2沉淀不完全;取最后一次洗涤液少许于试管中,加入过量HNO3溶液酸化,再加入AgNO3溶液,如果不出现白色沉淀,则说明已经洗干净。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
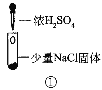
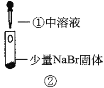
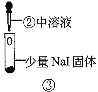
小学生10分钟应用题系列答案【题目】某小组比较Cl-、Br-、I-的还原性,实验如下:
实验1 | 实验2 | 实验3 | |
装置 |
|
|
|
现象 | 试管内颜色无明显变化;用蘸浓氨水的玻璃棒靠近管口,产生白烟。 | 溶液变黄;把湿润的KI淀粉试纸靠近试管口,变蓝。 | 溶液变深紫色;经检验溶液含单质碘。 |
下列对实验的分析合理的是
A.实验1中,白烟是(NH4)2SO4
B.根据实验1和实验2判断还原性:Br->Cl-
C.根据实验3判断还原性:I->Br-
D.上述实验利用了浓H2SO4的强酸性、强氧化性等性质