题目内容
20.某元素的原子个数为3.01×1022时,其质量为0.2g,该元素的相对原子质量最接近于下面哪个数值( )| A. | 1 | B. | 4 | C. | 7 | D. | 12 |
分析 根据一种元素的相对原子质量在数值上等于摩尔质量,先根据原子个数求出原子的物质的量n=$\frac{N}{{N}_{A}}$,然后根据摩尔质量M=$\frac{m}{n}$来求算.
解答 解:由于原子个数为3.01×1022,故原子的物质的量n=$\frac{N}{{N}_{A}}$=$\frac{3.01×1{0}^{22}}{6.02×1{0}^{23}}$=0.05mol,而摩尔质量M=$\frac{m}{n}$=$\frac{0.2g}{0.05mol}$=4g/mol,一种元素的相对原子质量在数值上等于摩尔质量,故该元素的相对原子质量为4,故选B.
点评 本题考查了相对分子质量的求算,熟练掌握公式的运用是解题关键,难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
6.下列有关化学用语表示正确的是( )
| A. | 中子数为21的钾原子:${\;}_{19}^{40}$K | |
| B. | 氯化钡的电子式:Ba2+[${\;}_{•}^{•}$$\underset{\stackrel{••}{ci}}{••}$${\;}_{•}^{•}$]${\;}_{2}^{-}$ | |
| C. | N3-的结构示意图: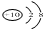 | |
| D. | 聚2-甲基-1,3-丁二烯的结构简式: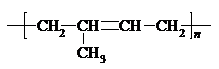 |
11.对相同物质的质量的SO2和SO3来说,下列关系不正确的是( )
| A. | 含氧原子个数比为2:3 | B. | 含硫元素质量比为1:1 | ||
| C. | 含氧元素质量比为5:6 | D. | 含硫原子个数比为1:1 |
15.有一种白色晶体A,加热后可完全变成气体,其中有一种气体能使湿润的红色石蕊试纸变蓝,另一种气体能使石灰水变浑浊.在A的溶液中加入少量CaCl2溶液,看不到白色沉淀.此白色晶体可能是( )
| A. | NH4Cl | B. | (NH4)2CO3 | C. | NH4NO3 | D. | NH4HCO3 |
5.同温同压下等质量的SO2和CO2相比较,下列各项正确的是( )
| A. | 原子个数之比为1:1 | B. | 物质的量之比为1:1 | ||
| C. | 体积之比为11:16 | D. | 分子数之比为1:1 |
12.2007年 7月2日,美、德两国成功合成具有化学特性的氢铝化合物 (AlH3)n,关于氢铝化合物的推测不正确的是( )
| A. | 氢铝化合物与水反应生成氢氧化铝和氢气 | |
| B. | 氢铝化合物中铝显+3价,H显-1价 | |
| C. | 铝与水蒸气高温下反应生成氢铝化合物 | |
| D. | 氢铝化合物具有强还原性 |
10.下列反应的离子方程式书写正确的是( )
| A. | 氯化铝溶液中加入过量氨水:Al3++4NH3.H2O=AlO2-+4NH4++2H2O | |
| B. | 澄清石灰水与少量苏打溶液混合:Ca2++OH-+HCO3-=CaCO3↓+H2O | |
| C. | 碳酸钙溶于醋酸:CaCO3+2H+=Ca2++CO2↑+H2O | |
| D. | 氯化亚铁溶液中通入氯气:2Fe2++Cl2=2Fe3++2Cl- |