题目内容
(2013?黄山一模)铁及其化合物在生产和生活中有着广泛的应用.
(1)氧化铁是重要工业颜料,用废铁屑制备它的流程如下:
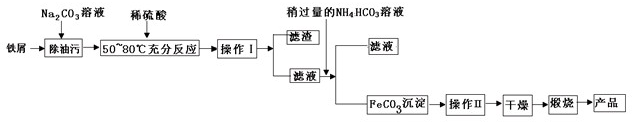
回答下列问题:
①操作Ⅰ、Ⅱ的名称分别是
②写出在空气中煅烧FeCO3的化学方程式
③.煅烧如果不充分,产品中将有Fe2+ 存在,试设计实验检验产品中有无Fe2+.
(2)有些同学认为KMnO4溶液滴定也能进行铁元素含量的测定.
a.称取2.850g绿矾(FeSO4?7H2O)产品,溶解,在250mL容量瓶中定容;
b.量取25.00mL待测溶液于锥形瓶中;
c.用硫酸酸化的0.01000mol/LKMnO4溶液滴定至终点,消耗KMnO4溶液体积的平均值为20.00mL.
①写出酸性KMnO4溶液与FeSO4溶液反应的离子方程式
②计算上述样品中FeSO4?7H2O的质量分数为
③滴定达到终点时锥形瓶中溶液颜色变化为
④下列操作会导致样品中FeSO4?7H2O的质量分数的测定结果偏高的有
a.未干燥锥形瓶
b.盛装标准液的滴定管没有用标准液润洗
c. 滴定终点时滴定管尖嘴中产生气泡
d.量取待测液,视线注视刻度时开始平视、结束俯视.
(1)氧化铁是重要工业颜料,用废铁屑制备它的流程如下:

回答下列问题:
①操作Ⅰ、Ⅱ的名称分别是
过滤
过滤
、洗涤
洗涤
.②写出在空气中煅烧FeCO3的化学方程式
4FeCO3+O2=2Fe2O3+4CO2
4FeCO3+O2=2Fe2O3+4CO2
;③.煅烧如果不充分,产品中将有Fe2+ 存在,试设计实验检验产品中有无Fe2+.
(2)有些同学认为KMnO4溶液滴定也能进行铁元素含量的测定.
a.称取2.850g绿矾(FeSO4?7H2O)产品,溶解,在250mL容量瓶中定容;
b.量取25.00mL待测溶液于锥形瓶中;
c.用硫酸酸化的0.01000mol/LKMnO4溶液滴定至终点,消耗KMnO4溶液体积的平均值为20.00mL.
①写出酸性KMnO4溶液与FeSO4溶液反应的离子方程式
MnO4-+5Fe2++8H+=5Fe3++Mn2++4H2O
MnO4-+5Fe2++8H+=5Fe3++Mn2++4H2O
②计算上述样品中FeSO4?7H2O的质量分数为
97.5%
97.5%
已知M(FeSO4?7H2O)=278g/mol]③滴定达到终点时锥形瓶中溶液颜色变化为
紫红色
紫红色
④下列操作会导致样品中FeSO4?7H2O的质量分数的测定结果偏高的有
b
b
.a.未干燥锥形瓶
b.盛装标准液的滴定管没有用标准液润洗
c. 滴定终点时滴定管尖嘴中产生气泡
d.量取待测液,视线注视刻度时开始平视、结束俯视.
分析:(1)①分离可溶物和不溶物用过滤,除去固体上的少量可溶性杂质用洗涤;
②FeCO3与氧气反应生成三氧化二铁和二氧化碳.
③依据煅烧反应不完全,生成氧化铁中含有碳酸亚铁,可以先加酸溶解,再加入高锰酸钾溶液检验亚铁离子的存在;
(2)①高锰酸钾溶液具有强氧化性,亚铁离子具有还原性,酸性溶液中亚铁离子被高锰酸钾氧化为铁离子,本身被还原为锰离子,结合电荷守恒,原子守恒配平书写;
②依据元素守恒和氧化还原反应计算得到;
③亚铁离子被氧化为三价铁离子,高锰酸钾溶液做指示剂,溶液呈紫红色;
④依据滴定过程中C(待测)=
,操作过程中引起误差需要分析道到标准液的体积变化分析;
②FeCO3与氧气反应生成三氧化二铁和二氧化碳.
③依据煅烧反应不完全,生成氧化铁中含有碳酸亚铁,可以先加酸溶解,再加入高锰酸钾溶液检验亚铁离子的存在;
(2)①高锰酸钾溶液具有强氧化性,亚铁离子具有还原性,酸性溶液中亚铁离子被高锰酸钾氧化为铁离子,本身被还原为锰离子,结合电荷守恒,原子守恒配平书写;
②依据元素守恒和氧化还原反应计算得到;
③亚铁离子被氧化为三价铁离子,高锰酸钾溶液做指示剂,溶液呈紫红色;
④依据滴定过程中C(待测)=
| C(标准)V(标准) |
| V(待测) |
解答:解:(1)①分离可溶物和不溶物用过滤,除去固体上的少量可溶性杂质用洗涤,故答案为:过滤;洗涤;
②在空气中煅烧FeCO3,FeCO3与氧气反应生成三氧化二铁和二氧化碳,故答案为:4FeCO3+O2
2Fe2O3+4CO2.
③煅烧如果不充分,产品中将有Fe2+ 存在,主要是Fe2O3和FeCO3,取样品放入试管中,加入稀硫酸溶解得到溶液,滴入高猛酸钾溶液,若滴入的高锰酸钾溶液褪色证明含有亚铁离子,否则不存在,故答案为:取样品放入试管中,加入稀硫酸溶解得到溶液,滴入高猛酸钾溶液,若滴入的高锰酸钾溶液褪色证明含有亚铁离子,否则不存在;
(2)①高锰酸钾溶液具有强氧化性,亚铁离子具有还原性,酸性溶液中亚铁离子被高锰酸钾氧化为铁离子,本身被还原为锰离子,酸性KMnO4溶液与FeSO4溶液反应的离子方程式:MnO4-+5Fe2++8H+=5Fe3++Mn2++4H2O;
②依据步骤分析,25ml溶液被高锰酸钾溶液滴定反应,终点时消耗亚铁离子物质的量为:
MnO4-+5Fe2++8H+=5Fe3++Mn2++4H2O;
1 5
0.0200L×0.0100mol/L n(Fe2+)
n(Fe2+)=0.00100mol;
配制的250ml溶液中含亚铁离子物质的量n=0.01mol;
样品中绿矾的质量分数=
×100%=97.5%
故答案为:97.5%
③滴定实验是利用高锰酸钾溶液的颜色变化指示反应终点,所以反应完全后,溶液呈紫红色,故答案为:紫红色
④滴定过程中C(待测)=
,
a、锥形瓶未干燥对滴定结果无影响,故a不选;
b、盛装标准液的滴定管没有用标准液润洗,高锰酸钾溶液变稀,滴定时消耗溶液体积增大,计算结果偏高,故b选;
c、滴定终点时滴定管尖嘴中产生气泡,消耗的高锰酸钾溶液体积偏小,计算结果偏小,故c不选;
d、量取待测液,是用滴定管,视线注视刻度时开始平视正确、结束俯视是液面定刻度,待测液体积读小,计算结果偏小;故d不选;
故选b;
②在空气中煅烧FeCO3,FeCO3与氧气反应生成三氧化二铁和二氧化碳,故答案为:4FeCO3+O2
| ||
③煅烧如果不充分,产品中将有Fe2+ 存在,主要是Fe2O3和FeCO3,取样品放入试管中,加入稀硫酸溶解得到溶液,滴入高猛酸钾溶液,若滴入的高锰酸钾溶液褪色证明含有亚铁离子,否则不存在,故答案为:取样品放入试管中,加入稀硫酸溶解得到溶液,滴入高猛酸钾溶液,若滴入的高锰酸钾溶液褪色证明含有亚铁离子,否则不存在;
(2)①高锰酸钾溶液具有强氧化性,亚铁离子具有还原性,酸性溶液中亚铁离子被高锰酸钾氧化为铁离子,本身被还原为锰离子,酸性KMnO4溶液与FeSO4溶液反应的离子方程式:MnO4-+5Fe2++8H+=5Fe3++Mn2++4H2O;
②依据步骤分析,25ml溶液被高锰酸钾溶液滴定反应,终点时消耗亚铁离子物质的量为:
MnO4-+5Fe2++8H+=5Fe3++Mn2++4H2O;
1 5
0.0200L×0.0100mol/L n(Fe2+)
n(Fe2+)=0.00100mol;
配制的250ml溶液中含亚铁离子物质的量n=0.01mol;
样品中绿矾的质量分数=
| 0.01mol×278g/mol |
| 2.850 |
故答案为:97.5%
③滴定实验是利用高锰酸钾溶液的颜色变化指示反应终点,所以反应完全后,溶液呈紫红色,故答案为:紫红色
④滴定过程中C(待测)=
| C(标准)V(标准) |
| V(待测) |
a、锥形瓶未干燥对滴定结果无影响,故a不选;
b、盛装标准液的滴定管没有用标准液润洗,高锰酸钾溶液变稀,滴定时消耗溶液体积增大,计算结果偏高,故b选;
c、滴定终点时滴定管尖嘴中产生气泡,消耗的高锰酸钾溶液体积偏小,计算结果偏小,故c不选;
d、量取待测液,是用滴定管,视线注视刻度时开始平视正确、结束俯视是液面定刻度,待测液体积读小,计算结果偏小;故d不选;
故选b;
点评:本题考查了铁及其化合物性质的分析应用,滴定实验的操作步骤和注意问题,滴定实验的计算应用,误差分析依据,题目难度中等.

练习册系列答案
 教材全解字词句篇系列答案
教材全解字词句篇系列答案
相关题目
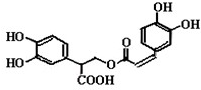 (2013?黄山一模)迷迭香酸是从蜂花属植物中提取得到的酸性物质,其结构如图.下列叙述正确的是( )
(2013?黄山一模)迷迭香酸是从蜂花属植物中提取得到的酸性物质,其结构如图.下列叙述正确的是( )