题目内容
【题目】现有FeCl3、AlCl3的混合溶液100mL,逐滴加入NaOH溶液,生成沉淀的物质的量随加入的NaOH的物质的量的关系如图. 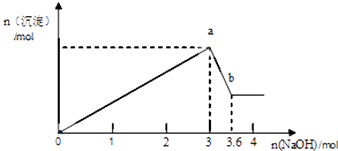
(1)a点对应的沉淀为(填化学式).
(2)计算原混合液中FeCl3的物质的量浓度为多少?
【答案】
(1)Fe(OH)3和Al(OH)3
(2)解:设FeCl3、AlCl3的物质的量分别为x、y,
0~a段反应,消耗NaOH溶液3mol
Fe3+ | + | 3OH﹣ | ═ | Fe(OH)3↓ |
1mol | 3mol | |||
x | 3x |
Al3+ | + | 3OH﹣ | ═ | Al(OH)3↓ |
1mol | 3mol | 1mol | ||
y | 3y | y |
3x+3y=3mol①
a~b段反应,消耗NaOH溶液(3.6﹣3)mol
Al(OH)3 | + | OH﹣ | ═ | AlO2﹣ | + | 2H2O |
1mol | 1mol | |||||
y | y |
y=0.6mol②
由①②解得x=0.4mol,即FeCl3的物质的量为0.6mol,c= ![]() =
= ![]() =4mol/L;
=4mol/L;
故答案为4mol/L
【解析】解:(1)向FeCl3、AlCl3的混合溶液中逐滴加入NaOH溶液,先发生的反应为:Fe3++3OH﹣═Fe(OH)3↓、Al3++3OH﹣═Al(OH)3↓(0~a段),继续滴加NaOH溶液,Al(OH)3沉淀溶解,Al(OH)3+OH﹣═AlO2﹣+2H2O(a~b段),a点对应的沉淀为Fe(OH)3和Al(OH)3 , b点,及b点后对应的沉淀为Fe(OH)3; 所以答案是:Fe(OH)3和Al(OH)3;

练习册系列答案
相关题目