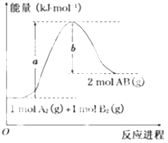
题目内容
【题目】镁和铝分别与等浓度、等体积的过量稀硫酸反应,产生气体的体积(V)与时间(t)关系如图.反应中镁和铝的关系说法正确的是( ) 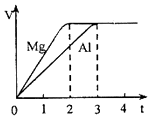
A.物质的量之比为3:2
B.质量之比为3:4
C.摩尔质量之比为9:8
D.体积之比为2:3
【答案】A
【解析】解:A、由于Mg~H2 , 2Al~3H2 , 且两种金属得到的氢气一样多,因此镁和铝的物质的量的比是1: ![]() =3:2,故A正确; B、由于Mg~H2 , 2Al~3H2 , 且两种金属得到的氢气一样多,因此镁和铝的物质的量的比是1:
=3:2,故A正确; B、由于Mg~H2 , 2Al~3H2 , 且两种金属得到的氢气一样多,因此镁和铝的物质的量的比是1: ![]() =3:2,则它们的质量的比为(3×24):(2×27)=4:3,故B错误;
=3:2,则它们的质量的比为(3×24):(2×27)=4:3,故B错误;
C、镁和铝的摩尔质量之比和该化学反应毫无关系,即它们的摩尔质量之比为24g/mol:27g/mol=8:9,故C错误;
D、根据B的分析,金属镁和铝的质量的比为(3×24):(2×27)=4:3,体积等于质量和密度之比,所以金属的体积之比还得借助密度数据计算,故D错误;
故选A.
根据图象可知,两种金属得到的氢气一样多,然后根据金属镁、铝和足量的稀硫酸反应的化学方程式:Mg+H2SO4=MgSO4+H2↑,2Al+3H2SO4=Al2(SO4)3+3H2↑,即可找出各个量之间的关系.

练习册系列答案
 举一反三单元同步过关卷系列答案
举一反三单元同步过关卷系列答案
相关题目